의약품 제조업체: Genentech, Inc. (Updated: 2024-08-19)
처방 정보의 주요 내용
XOLAIR® (omalizumab) 주사, 피하 주사용
XOLAIR® (omalizumab) 주사, 피하 주사용
미국 최초 승인: 2003
경고: 아나필락시스
전체 박스 경고에 대한 전체 처방 정보를 참조하십시오.
기관지 경련, 저혈압, 실신, 두드러기 및/또는 인후 또는 혀의 혈관 부종으로 나타나는 아나필락시스가 XOLAIR 투여 후 발생한 것으로 보고되었습니다. 아나필락시스는 XOLAIR 첫 번째 투여 후 발생했지만 치료 시작 후 1년 이상 지나서도 발생했습니다. XOLAIR 치료는 의료 환경에서 시작하고, XOLAIR 투여 후 적절한 기간 동안 환자를 면밀히 관찰하고, 생명을 위협할 수 있는 아나필락시스를 관리할 준비를 하십시오. 환자에게 아나필락시스의 징후와 증상을 알리고 증상이 나타나면 즉시 의료 서비스를 받도록 하십시오. XOLAIR 자가 투여를 위한 환자 선택은 아나필락시스 위험을 완화하기 위한 기준을 기반으로 해야 합니다. (2.6, 5.1, 6.1, 6.2)
최근 주요 변경 사항
| 적응증 및 사용, IgE 매개 식품 알레르기 (1.3) | 2/2024 |
| 투여량 및 투여 방법 (2.1, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8) | 2/2024 |
| 경고 및 주의 사항 (5.1, 5.8, 5.9) | 2/2024 |
처방 정보 주요 내용
XOLAIR는 항-IgE 항체로 다음에 사용됩니다:
- 만성적인 알레르기 항원에 대한 피부 반응 검사 또는 체외 반응 검사 결과가 양성이고 흡입용 코르티코스테로이드로 적절히 조절되지 않는 성인 및 6세 이상 소아의 중등도에서 중증의 지속적인 천식 (1.1)
- 코르티코스테로이드 비강 분무제에 대한 반응이 불충분한 18세 이상 성인의 비강용 코르티코스테로이드 추가 유지 요법으로서의 만성 비강-부비강염과 비용종 (1.2)
- 1세 이상의 성인 및 소아의 IgE 매개 식품 알레르기로, 하나 이상의 식품에 우연히 노출되었을 때 발생할 수 있는 알레르기 반응(I형), 즉 아나필락시스를 줄이기 위해 사용됩니다. 식품 알레르기원 회피와 함께 사용해야 합니다. (1.3)
- H1 항히스타민제 치료에도 증상이 지속되는 12세 이상의 성인 및 청소년의 만성 자발성 두드러기 (1.4)
사용 제한:
투여량 및 투여 방법
피하(SC) 투여 전용입니다. (2.2, 2.3, 2.4, 2.5)
투여 지침은 전체 처방 정보를 참조하십시오. (2.6, 2.7, 2.8)
- 천식: XOLAIR 75~375mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 투여량(mg)과 투여 빈도를 결정합니다. 투여량 결정 차트를 참조하십시오. (2.2)
- 만성 비강-부비강염과 비용종: XOLAIR 75~600mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 투여량(mg)과 투여 빈도를 결정합니다. 투여량 결정 차트를 참조하십시오. (2.3)
- IgE 매개 식품 알레르기: XOLAIR 75~600mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 투여량(mg)과 투여 빈도를 결정합니다. 투여량 결정 차트를 참조하십시오. (2.4)
- 만성 자발성 두드러기: XOLAIR 150 또는 300mg을 4주마다 피하 투여합니다. CSU의 투여량은 혈청 IgE 수치 또는 체중에 따라 결정되지 않습니다. (2.5)
투여 형태 및 강도
금기 사항
XOLAIR 또는 XOLAIR의 성분에 대한 중증의 과민 반응 (4, 5.1)
처방 정보 주요 사항
- 아나필락시스: 아나필락시스는 생명을 위협할 수 있으며, 아나필락시스를 관리할 준비가 된 의료 환경에서 XOLAIR 치료를 시작하고 투여 후 적절한 시간 동안 환자를 관찰하십시오. (5.1)
- 악성 종양: 임상 연구에서 악성 종양이 관찰되었습니다. (5.2)
- 급성 천식 증상: 급성 기관지 경련 또는 천식 발작 치료에는 사용하지 마십시오. (5.3)
- 코르티코스테로이드 감량: XOLAIR 치료를 시작할 때 코르티코스테로이드를 갑자기 중단하지 마십시오. (5.4)
- 호산구성 질환: 특히 경구 코르티코스테로이드 감량 시 호산구 증가증, 혈관염 발진, 악화되는 폐 증상, 심장 합병증 및/또는 신경병증에 유의하십시오. (5.5)
- 발열, 관절통 및 발진: 환자가 혈청병과 유사한 징후와 증상을 보이면 XOLAIR를 중단하십시오. (5.6)
- 아나필락시스의 응급 치료와 관련된 잠재적인 약물 오류: XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에 사용해서는 안 됩니다. (5.9)
부작용
- 천식: 성인 및 12세 이상 청소년 환자를 대상으로 한 임상 연구에서 가장 흔한 부작용(≥ 1% 환자)은 관절통, 통증(전반적), 다리 통증, 피로, 현기증, 골절, 팔 통증, 가려움증, 피부염 및 귀 통증이었습니다. 6세에서 12세 미만의 소아 환자를 대상으로 한 임상 연구에서 가장 흔한 부작용(≥ 3% 환자)은 비인두염, 두통, 발열, 상복부 통증, 연쇄상 구균 인두염, 중이염, 바이러스성 위장염, 절지동물 물림 및 코피였습니다. (6.1)
- 비강용종을 동반한 만성 비부비강염: 성인 환자를 대상으로 한 임상 연구에서 가장 흔한 부작용(≥ 3% 환자)은 두통, 주사 부위 반응, 관절통, 상복부 통증 및 현기증이었습니다. (6.1)
- IgE 매개 식품 알레르기: 가장 흔한 부작용(≥ 3% 환자)은 주사 부위 반응 및 발열이었습니다. (6.1)
- 만성 자발성 두드러기: 가장 흔한 부작용(≥ 2% 환자)은 메스꺼움, 비인두염, 축농증, 상기도 감염, 바이러스성 상기도 감염, 관절통, 두통 및 기침이었습니다. (6.1)
의심되는 부작용을 보고하려면 Genentech에 1-888-835-2555 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
정식 약물 상호 작용 연구는 수행되지 않았습니다. (7)
환자 상담 정보 및 약물 안내서를 보려면 17을 참조하십시오.
개정: 2024년 2월
목차
전문 정보: 목차*
경고: 아나필락시스
1 적응증 및 사용법
1.1 천식
1.2 비강용종을 동반한 만성 비부비동염
1.3 IgE 매개 식품 알레르기
1.4 만성 자발적 두드러기
2 용법 및 용량
2.1 용량 결정 개요
2.2 천식에 대한 권장 용량
2.3 비강용종을 동반한 만성 비부비동염에 대한 권장 용량
2.4 IgE 매개 식품 알레르기에 대한 권장 용량
2.5 만성 자발적 두드러기에 대한 권장 용량
2.6 투여 개요
2.7 XOLAIR 사전 충전 주사기 및 오토인젝터
2.8 XOLAIR 동결 건조 분말 사용 및 주사 준비
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 아나필락시스
5.2 악성 종양
5.3 급성 천식 증상 및 악화되는 질병
5.4 코르티코스테로이드 감량
5.5 호산구성 질환
5.6 발열, 관절통 및 발진
5.7 기생충 (회충) 감염
5.8 실험실 검사
5.9 아나필락시스 응급 치료와 관련된 잠재적인 약물 오류
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 천식
14.2 비강용종을 동반한 만성 비부비동염
14.3 IgE 매개 식품 알레르기
14.4 만성 자발적 두드러기
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: 아나필락시스
기관지 경련, 저혈압, 실신, 두드러기 및/또는 후두 또는 혀의 혈관 부종으로 나타나는 아나필락시스가 XOLAIR 투여 후 발생하는 것으로 보고되었습니다. 아나필락시스는 XOLAIR의 첫 번째 용량 투여 후 빠르게 발생했지만, 정기적으로 투여되는 치료를 시작한 후 1년이 지나서도 발생했습니다. 아나필락시스의 위험 때문에 의료 시설에서 XOLAIR 치료를 시작하고 XOLAIR 투여 후 적절한 시간 동안 환자를 주의 깊게 관찰해야 합니다. XOLAIR를 투여하는 의료 서비스 제공자는 생명을 위협할 수 있는 아나필락시스를 관리할 준비를 갖춰야 합니다. 환자에게 아나필락시스의 징후와 증상을 알리고 증상이 나타나면 즉시 치료를 받도록 지시하십시오. XOLAIR 자가 투여 환자의 선택은 아나필락시스로 인한 위험을 완화하기 위한 기준을 기반으로 해야 합니다. [복용량 및 투여(2.6), 경고 및 주의사항(5.1) 및 이상 반응(6.1, 6.2)]을 참조하십시오.
1 적응증 및 용법
1.1 천식
XOLAIR는 계절성 알레르기 항원에 대한 피부 반응 검사 또는 체외 반응 검사 결과가 양성이고, 흡입용 코르티코스테로이드로 증상이 적절히 조절되지 않는 중등도에서 중증의 지속적인 천식 환자의 성인 및 6세 이상 소아 환자에게 적응증이 있습니다.
1.2 비강용종을 동반한 만성 비부비동염
XOLAIR는 비강 코르티코스테로이드에 대한 반응이 불충분한 18세 이상 성인 환자의 비강용종을 동반한 만성 비부비동염(CRSwNP)의 추가 유지 치료에 적응증이 있습니다.
1.3 IgE 매개 식품 알레르기
XOLAIR는 IgE 매개 식품 알레르기가 있는 1세 이상 성인 및 소아 환자에서 우발적인 한 가지 이상의 식품 노출로 인해 발생할 수 있는 알레르기 반응(I형), 즉 아나필락시스를 감소시키는 데 적응증이 있습니다.
XOLAIR는 식품 알레르기 회피와 함께 사용해야 합니다.
1.4 만성 자발성 두드러기
XOLAIR는 H1 항히스타민제 치료에도 불구하고 증상이 지속되는 만성 자발성 두드러기(CSU)가 있는 12세 이상 성인 및 청소년에게 적응증이 있습니다.
2 투여 및 관리
2.1 투여량 결정 개요
천식, 비강용종을 동반한 만성 비부비동염 및 IgE 매개 식품 알레르기
- XOLAIR의 투여량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 결정합니다.
- 천식, 비강용종을 동반한 만성 비부비동염(CRSwNP) 및 IgE 매개 식품 알레르기 환자의 경우 XOLAIR가 처방되는 주요 진단을 기반으로 투여량을 결정해야 합니다.
- 치료 중 체중이 크게 변하면 투여량을 조절합니다.
- 천식 치료를 위한 권장 투여량은 표 1 및 2를, CRSwNP 치료를 위한 권장 투여량은 표 3을, IgE 매개 식품 알레르기 치료를 위한 권장 투여량은 표 4를 참조하십시오.
- 총 IgE 수치는 치료 중에 상승하며 치료 중단 후 최대 1년까지 상승된 상태를 유지합니다. 따라서 XOLAIR 치료 중 IgE 수치를 재검사하여 투여량을 결정하는 데 사용할 수 없습니다.
만성 자발성 두드러기
만성 자발성 두드러기(CSU) 환자의 경우 XOLAIR 투여량은 혈청 IgE(자유 또는 총) 수치 또는 체중에 의존하지 않습니다 [투여 및 관리(2.5) 참조].
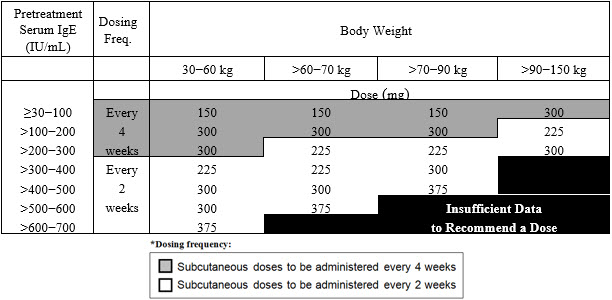
2.2 천식에 대한 권장 투여량
천식에 대한 권장 투여량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 2주 또는 4주마다 피하 주사로 XOLAIR 75mg~375mg을 투여합니다 [투여 및 관리(2.1) 참조].
 |
 |
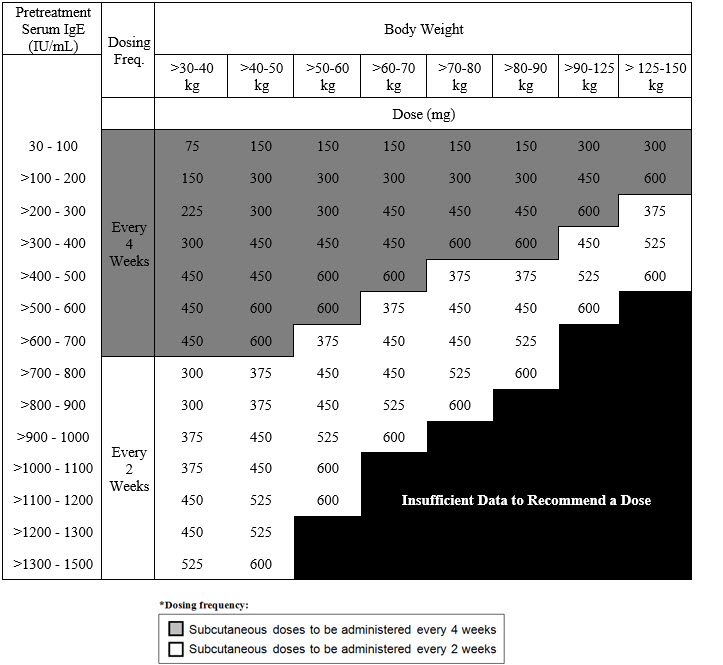
2.3 비강용종을 동반한 만성 비부비동염에 대한 권장 투여량
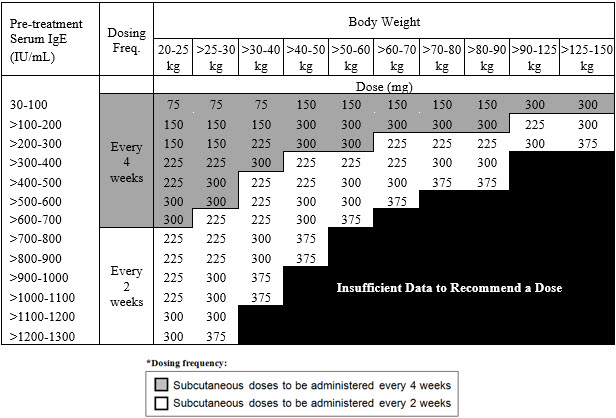
비강용종을 동반한 만성 비부비동염(CRSwNP)에 대한 권장 투여량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)에 따라 2주 또는 4주마다 피하 주사로 XOLAIR 75mg~600mg을 투여합니다 [투여 및 관리(2.1) 참조]. CRSwNP 환자의 경우 혈청 총 IgE 수치와 체중에 따른 권장 투여량은 표 3을 참조하십시오.
 |
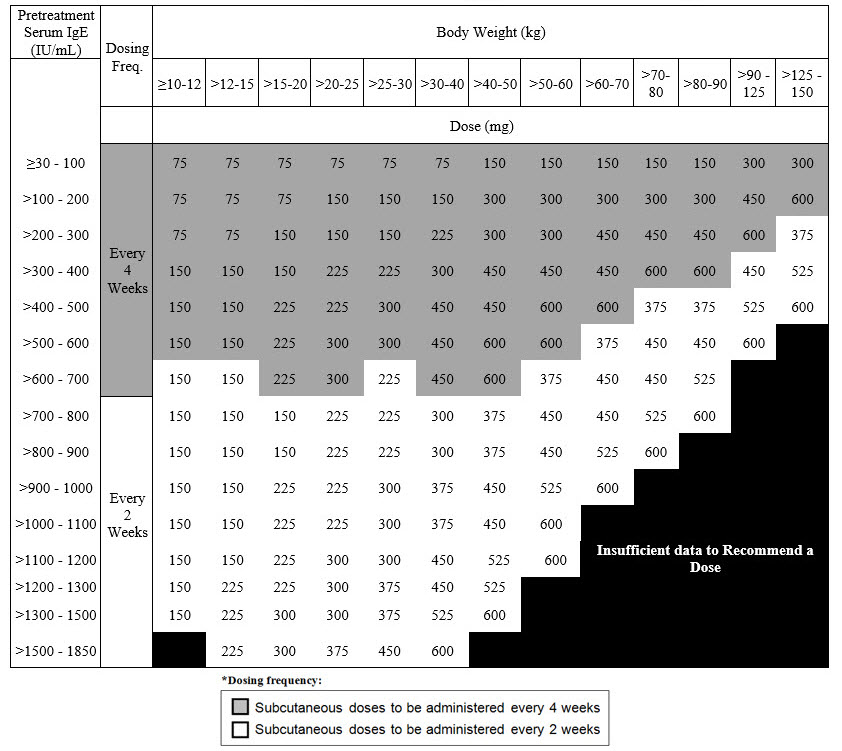
2.4 IgE 매개 식품 알레르기에 대한 권장 용량
IgE 매개 식품 알레르기에 대한 권장 용량은 치료 시작 전에 측정한 혈청 총 IgE 수치 (IU/mL) 및 체중에 따라 2주 또는 4주마다 피하 주사로 XOLAIR 75mg에서 600mg입니다 [용량 및 투여 (2.1) 참조]. IgE 매개 식품 알레르기가 있는 환자의 혈청 IgE 수치 및 체중에 따른 권장 용량은 표 4를 참조하십시오.
 |
2.5 만성 자발성 두드러기 권장 용량
만성 자발성 두드러기(CSU)에 대한 권장 용량은 4주마다 피하 주사로 XOLAIR 150mg 또는 300mg입니다.
- 300mg 용량은 300mg/2mL의 피하 주사 한 번 또는 150mg/mL의 피하 주사 두 번으로 투여할 수 있습니다.
- CSU 환자에서 XOLAIR의 용량은 혈청 IgE(유리 또는 총) 수치 또는 체중에 의존하지 않습니다.
2.6 투여 개요
- 피하 주사로 XOLAIR를 투여하십시오.
- XOLAIR는 의료 전문가의 지시에 따라 사용하도록 되어 있습니다.
- 의료 환경에서 치료를 시작하고 치료가 안전하게 확립되면 의료 전문가는 아나필락시스 위험 및 완화 전략에 대한 신중한 평가를 기반으로 환자 또는 보호자가 XOLAIR 사전 충전 주사기 또는 자동 주사기를 자가 투여할 수 있는지 여부를 결정할 수 있습니다.
XOLAIR 사전 충전 주사기 또는 자동 주사기 자가 투여를 위한 환자 선택
의료 전문가는 XOLAIR에 대한 아나필락시스 위험 요인 [경고 및 주의 사항(5.1) 참조] 및 완화 전략을 고려하여 자가 투여를 위한 환자를 선택해야 합니다. 다음 기준을 포함한 환자 특정 요인을 고려해야 합니다.
- 1a)
- 천식, CRSwNP 및 CSU: 환자는 XOLAIR 또는 식품, 약물, 생물학적 제제 등과 같은 다른 약물에 대한 아나필락시스 병력이 없어야 합니다.
- 1b)
- IgE 매개 식품 알레르기: 환자는 XOLAIR 또는 다른 약물(식품 제외)에 대한 아나필락시스 병력이 없어야 합니다.
- 2)
- 환자는 의료 전문가의 지시에 따라 과민 반응 없이 XOLAIR를 최소 3회 투여받아야 합니다.
- 3)
- 환자 또는 보호자는 아나필락시스 증상을 인식할 수 있어야 합니다.
- 4)
- 환자 또는 보호자는 아나필락시스를 적절하게 치료할 수 있어야 합니다.
- 5)
- 환자 또는 보호자는 처방된 용량 요법 및 사용 지침에 따라 적절한 기술로 XOLAIR 사전 충전 주사기 또는 자동 주사기를 사용하여 피하 주사를 할 수 있어야 합니다.
2.7 XOLAIR 사전 충전 주사기 및 자동 주사기
XOLAIR 주사 용량은 사전 충전 주사기 또는 자동 주사기로 제공됩니다. 환자 또는 보호자에게 XOLAIR 사전 충전 주사기 또는 자동 주사기의 준비 및 투여에 대한 “사용 지침“에 제공된 지침을 따르도록 지시하십시오. [사용 지침 참조].
XOLAIR 사전 충전 주사기
- 12세 이상 청소년: XOLAIR 사전 충전 주사기는 성인 감독 하에 자가 투여할 수 있습니다.
- 1~11세 소아 환자: XOLAIR 사전 충전 주사기는 보호자가 투여해야 합니다.
XOLAIR 자동 주사기
- 12세 이상 청소년: XOLAIR 자동 주사기는 성인 감독 하에 자가 투여할 수 있습니다. XOLAIR 자동 주사기(모든 용량)는 성인 및 12세 이상 청소년에게만 사용하도록 되어 있습니다.
- 1~11세 소아 환자: XOLAIR 자동 주사기(모든 용량)는 사용하지 마십시오 12세 미만 소아 환자에게 사용하지 마십시오.
사전 충전 주사기 및 자동 주사기 투여 지침
- 라텍스 알레르기가 있는 사람은 XOLAIR 사전 충전 주사기를 취급해서는 안 됩니다. XOLAIR 75mg/0.5mL 및 150mg/mL 사전 충전 주사기의 바늘 캡에는 천연 고무 라텍스 유도체가 포함되어 있어 라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있습니다 [제공/보관 및 취급(16) 참조].
- 투여 전에 사전 충전 주사기 또는 오토인젝터의 내용물을 시각적으로 검사하여 이물질과 변색이 있는지 확인하십시오. XOLAIR 사전 충전 주사기 또는 오토인젝터 용액은 투명하고 무색에서 옅은 갈색을 띠어야 합니다. 약물이 흐리거나 변색되었거나 입자가 포함되어 있는 경우 사전 충전 주사기 또는 오토인젝터를 사용하지 마십시오.
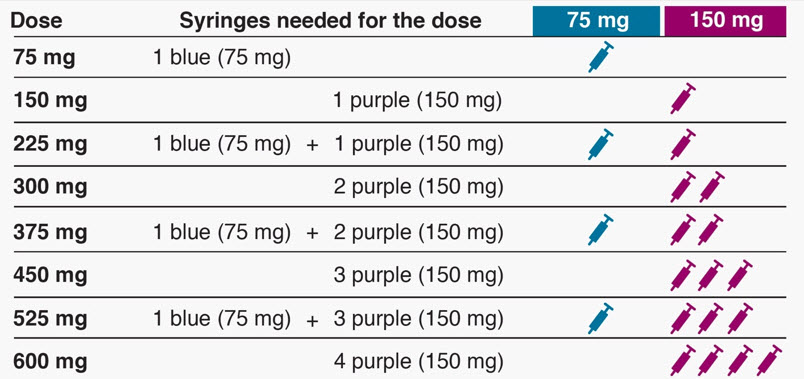
- 환자의 복용량에 필요한 사전 충전 주사기 또는 오토인젝터의 수를 결정하십시오(표 5 참조). 1세에서 11세까지의 소아 환자의 경우 환자의 체중에 비례하여 필요한 사전 충전 주사기 주사의 수와 주입할 용량을 고려해야 합니다.
- 전체 복용량을 완료하기 위해 2회 이상 주사가 필요한 환자의 경우 각 주사를 다른 주사 부위에서 최소 1인치 떨어진 곳에 투여하십시오.
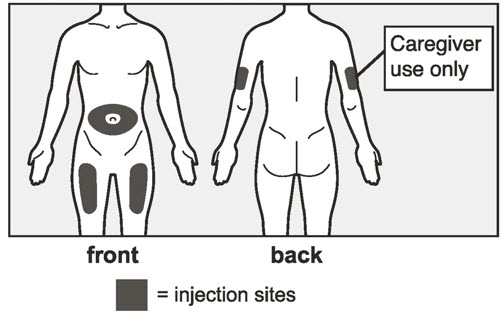
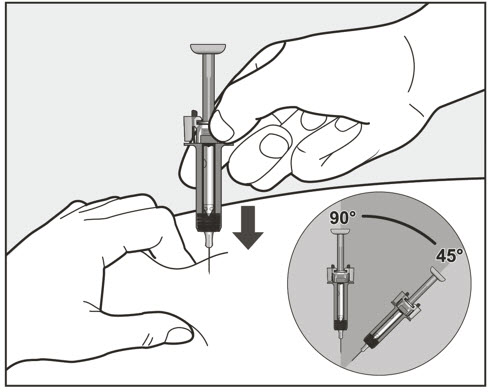
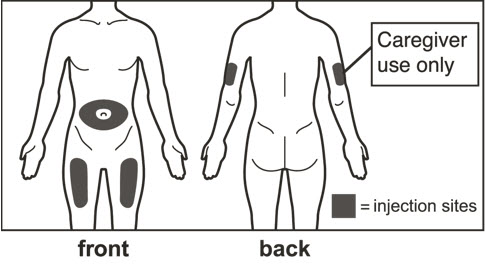
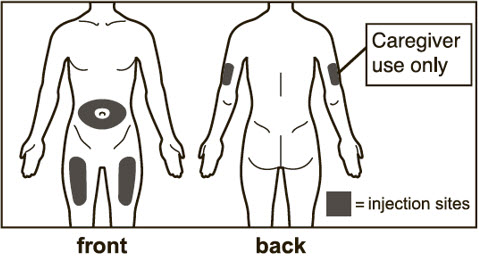
- 배꼽 주변 2인치(5cm) 영역을 피하여 허벅지 또는 복부에 피하 주사를 투여하십시오. 상완 외측 부위는 간병인 또는 의료 제공자가 주사를 투여하는 경우에만 사용할 수 있습니다 [사용 지침 참조]. 주사는 최대 15초 동안 지속될 수 있습니다.
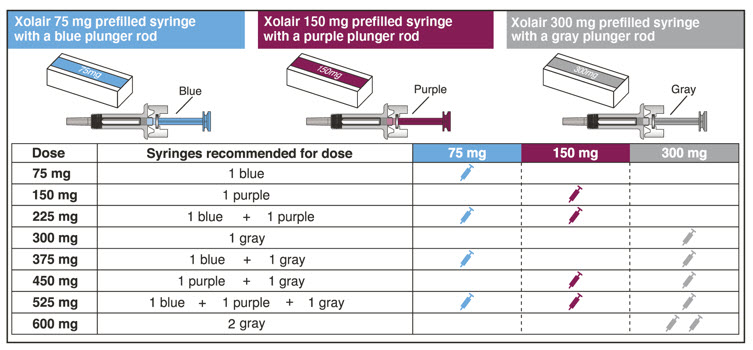
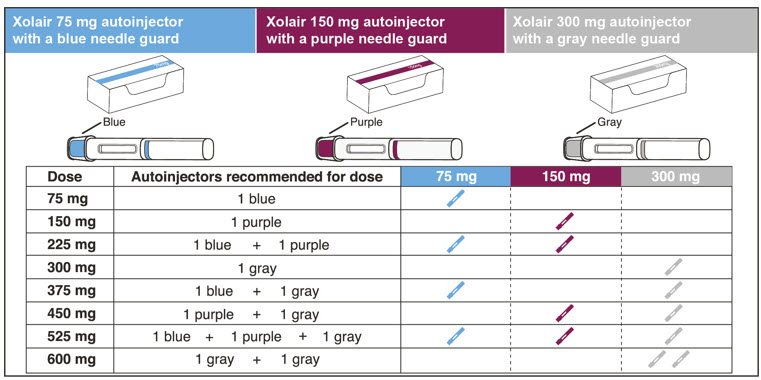
| XOLAIR 복용량‡ | 75mg | 150mg | 300mg‡ | 총 주입량 |
|---|---|---|---|---|
|
||||
| 75mg | 1 | 0 | 0 | 0.5mL |
| 150mg | 0 | 1 | 0 | 1mL |
| 225mg | 1 | 1 | 0 | 1.5mL |
| 300mg | 0 | 0 | 1 | 2mL |
| 375mg | 1 | 0 | 1 | 2.5mL |
| 450mg | 0 | 1 | 1 | 3mL |
| 525mg | 1 | 1 | 1 | 3.5mL |
| 600mg | 0 | 0 | 2 | 4mL |
2.8 XOLAIR 동결건조 분말의 사용 및 주사 준비
XOLAIR 동결건조 분말은 의료 전문가만 준비하고 주사해야 합니다. 제공된 XOLAIR 동결건조 분말은 다음 지침에 따라 주사용 멸균수(SWFI) USP로 재구성해야 합니다.
- 1)
- 재구성 전에 재구성해야 할 바이알 수를 결정합니다(각 바이알은 1.2mL에 XOLAIR 150mg을 제공합니다)(표 6 참조).
| XOLAIR 용량* | 바이알 수 | 주사 횟수 | 총 주사량 |
|---|---|---|---|
|
|||
| 75 mg | 1 | 1 | 0.6 mL |
| 150 mg | 1 | 1 | 1.2 mL |
| 225 mg | 2 | 2 | 1.8 mL |
| 300 mg | 2 | 2 | 2.4 mL |
| 375 mg | 3 | 3 | 3.0 mL |
| 450 mg | 3 | 3 | 3.6 mL |
| 525 mg | 4 | 4 | 4.2 mL |
| 600 mg | 4 | 4 | 4.8 mL |
- 2)
- 1인치, 18게이지 바늘이 장착된 3mL 주사기에 SWFI, USP 1.4mL를 뽑습니다.
- 3)
- 바이알을 평평한 표면에 세워 놓고 표준 무균 기법을 사용하여 바늘을 삽입하고 제품에 직접 SWFI, USP를 주입합니다.
- 4)
- 바이알을 세운 상태로 유지하고 약 1분 동안 부드럽게 흔들어 분말을 고르게 적셔줍니다. 흔들지 마십시오.
- 5)
- 남아 있는 고형물을 용해시키기 위해 약 5분마다 5~10초 동안 부드럽게 흔들어줍니다. 동결건조 제품은 용해되는 데 15~20분이 걸립니다. 완전히 용해되는 데 20분 이상 걸리는 경우 용액에 눈에 띄는 젤리 같은 입자가 없어질 때까지 약 5분마다 5~10초 동안 부드럽게 흔들어줍니다. 40분 이내에 바이알 내용물이 완전히 용해되지 않으면 사용하지 마십시오.
- 6)
- 재구성 후 XOLAIR 용액은 약간 점성이 있으며 투명하거나 약간 불투명하게 보입니다. 바이알 가장자리에 작은 기포나 거품이 있는 것은 허용됩니다. 재구성된 용액에는 눈에 띄는 젤리 같은 입자가 없어야 합니다. 이물질이 있는 경우 사용하지 마십시오.
- 7)
- 용액이 마개 쪽으로 배수되도록 바이알을 15초 동안 거꾸로 뒤집습니다.
- 8)
- 재구성 후 바이알을 2ºC~8ºC(36ºF~46ºF)에서 보관하면 8시간 이내에, 실온에서 보관하면 4시간 이내에 XOLAIR 용액을 사용하십시오. 재구성된 XOLAIR 바이알은 햇빛을 피하십시오.
- 9)
- 1인치, 18게이지 바늘이 장착된 새 3mL 주사기를 사용하여 바늘을 거꾸로 뒤집은 바이알에 삽입합니다. 용액을 주사기에 뽑을 때 바늘 끝을 바이알 마개의 용액 가장 아래쪽에 위치시킵니다. 재구성된 제품은 약간 점성이 있습니다. 바이알에서 모든 제품을 뽑아낸 후 주사기에서 공기나 과도한 용액을 배출합니다. 바늘을 바이알에서 빼기 전에 주사기 피스톤을 주사기 배럴 끝까지 완전히 당겨 거꾸로 뒤집은 바이알에서 모든 용액을 뽑아냅니다.
- 10)
- 피하 주사를 위해 18게이지 바늘을 25게이지 바늘로 교체합니다.
- 11)
- XOLAIR 150mg 용량에 해당하는 1.2mL의 용량을 얻으려면 공기, 큰 기포 및 과도한 용액을 배출합니다. XOLAIR 75mg 용량에 해당하는 0.6mL의 용량을 얻으려면 공기, 큰 기포를 배출하고 주사기에서 0.6mL를 버립니다. 주사기 용액 위에 얇은 층의 작은 기포가 남아 있을 수 있습니다.
- 12)
- XOLAIR를 피하 주사합니다. 용액이 약간 점성이 있기 때문에 주사하는 데 5~10초가 걸릴 수 있습니다. 한 주사 부위에 150mg(바이알 1개의 내용물) 이상 주사하지 마십시오. 150mg을 초과하는 용량은 두 개 이상의 주사 부위에 나누어 주사합니다. 다른 주사 부위에 사용된 부위에서 최소 1인치 떨어진 곳에 각 새 주사를 위한 다른 주사 부위를 선택하십시오.
3 제형 및 함량
주사:
- 75 mg/0.5 mL는 바늘 보호대가 있는 단회용 미리 채워진 주사기 또는 단회용 미리 채워진 자동 주사기에 투명하거나 약간 유백색이며 무색에서 옅은 갈색을 띠는 용액입니다.
- 150 mg/mL는 바늘 보호대가 있는 단회용 미리 채워진 주사기 또는 단회용 미리 채워진 자동 주사기에 투명하거나 약간 유백색이며 무색에서 옅은 갈색을 띠는 용액입니다.
- 300 mg/2 mL는 바늘 보호대가 있는 단회용 미리 채워진 주사기에 투명하거나 약간 유백색이며 무색에서 옅은 갈색을 띠는 용액입니다.
- 주사용: 150 mg의 백색 동결 건조 분말이 단회용 바이알에 들어 있으며 재구성됩니다.
4 금기사항
XOLAIR는 XOLAIR 또는 XOLAIR의 성분에 대한 중증 과민 반응이 있는 환자에게 금기입니다 [경고 및 주의 사항 (5.1) 참조].
5 경고 및 주의사항
5.1 Anaphylaxis
사전 마케팅 임상 시험 및 시판 후 자발적 보고에서 XOLAIR 투여 후 아나필락시스가 발생했다고 보고되었습니다 [see Boxed Warning and Adverse Reactions (6.2)]. 이러한 보고된 사례에서 나타난 징후 및 증상으로는 기관지 경련, 저혈압, 실신, 두드러기 및/또는 목구멍이나 혀의 혈관부종이 있습니다. 이러한 사례 중 일부는 생명을 위협했습니다. 천식 환자를 대상으로 한 사전 마케팅 임상 시험에서 3,507명 중 3명(0.1%)의 환자에게서 아나필락시스가 보고되었습니다. 아나필락시스는 두 명의 환자에게서 첫 번째 XOLAIR 투여 시, 한 명의 환자에게서 네 번째 투여 시 발생했습니다. 아나필락시스가 시작된 시간은 두 명의 환자에게서 투여 후 90분이었고, 한 명의 환자에게서는 투여 후 2시간이었습니다.
천식 환자를 대상으로 한 사례 대조 연구에 따르면 XOLAIR 사용자 중 음식, 약물 또는 기타 원인으로 인한 아나필락시스 과거력이 있는 환자는 아나필락시스 과거력이 없는 환자에 비해 XOLAIR와 관련된 아나필락시스 위험이 증가했습니다 [see Adverse Reactions (6.1)].
시판 후 자발적 보고에서 XOLAIR 사용으로 인한 아나필락시스 빈도는 2003년 6월부터 2006년 12월까지 약 57,300명의 환자를 대상으로 추정한 결과, 환자의 최소 0.2%인 것으로 추정되었습니다. 아나필락시스는 첫 번째 XOLAIR 투여 후 빠르게 발생했지만, 정기적인 치료를 시작한 지 1년이 지난 후에도 발생했습니다. 아나필락시스 사례의 약 60~70%가 XOLAIR를 처음 세 번 투여하는 동안 보고되었으며, 세 번째 투여 이후 간헐적으로 추가 사례가 발생했습니다.
생명을 위협할 수 있는 아나필락시스를 관리할 수 있는 의료 환경에서만 XOLAIR를 시작하십시오. 사전 마케팅 임상 시험 및 시판 후 자발적 보고에서 나타난 아나필락시스 발생 시간을 고려하여 XOLAIR 투여 후 적절한 시간 동안 환자를 주의 깊게 관찰하십시오 [see Adverse Reactions (6.1, 6.2)]. 환자에게 아나필락시스의 징후와 증상을 알리고, 징후나 증상이 나타나면 즉시 치료를 받도록 지시하십시오.
XOLAIR 치료가 확립되면, 환자 또는 간병인이 의료 환경 외부에서 XOLAIR 프리필드 주사기 또는 자동 주사기를 투여하는 것이 선택된 환자에게 적합할 수 있습니다. 의료 제공자가 환자와 상의하여 결정하는 환자 선택은 사전 마케팅 임상 시험 및 시판 후 자발적 보고에서 나타난 아나필락시스 사례 패턴과 개별 환자의 위험 요소(예: 아나필락시스 과거력), 아나필락시스 징후 및 증상 인지 능력, 처방된 투여 요법 및 사용 설명서에 따라 적절한 기술로 XOLAIR 프리필드 주사기 또는 자동 주사기를 사용한 피하 주사 수행 능력을 고려해야 합니다. [see Dosage and Administration (2.6), Adverse Reactions (6.1, 6.2)].
중증 과민 반응을 경험한 환자에게서는 XOLAIR를 중단하십시오 [see Contraindications (4)].
5.2 Malignancy
천식 및 기타 알레르기 질환이 있는 12세 이상의 성인 및 청소년을 대상으로 한 임상 연구에서 4,127명의 XOLAIR 치료 환자 중 20명(0.5%)에서 악성 종양이 관찰되었으며, 2,236명의 대조군 환자 중 5명(0.2%)에서 악성 종양이 관찰되었습니다. XOLAIR 치료 환자에서 관찰된 악성 종양은 다양한 유형이었으며, 유방암, 비흑색종 피부암, 전립선암, 흑색종, 이하선암이 두 번 이상 발생했으며, 다른 다섯 가지 유형은 각각 한 번씩 발생했습니다. 대부분의 환자는 1년 미만 동안 관찰되었습니다. XOLAIR에 장기간 노출되거나 악성 종양 위험이 높은 환자(예: 노인, 현재 흡연자)에게 사용했을 때의 영향은 알려져 있지 않습니다.
이후 중증 지속성 천식과 다년생 공기 알레르겐에 대한 양성 피부 검사 반응 또는 시험관 내 반응성을 보이는 5,007명의 XOLAIR 치료 환자와 2,829명의 비 XOLAIR 치료 청소년 및 성인 환자를 대상으로 한 관찰 연구에서 환자들을 최대 5년 동안 추적 관찰했습니다. 이 연구에서 원발성 악성 종양의 발생률(환자 1,000명당 연간)은 XOLAIR 치료 환자(12.3)와 비 XOLAIR 치료 환자(13.0) 간에 유사했습니다 [see Adverse Reactions (6.1)]. 그러나 연구의 제한으로 인해 XOLAIR로 인한 악성 종양 위험을 확실하게 배제할 수 없습니다. 연구의 제한 사항에는 관찰 연구 설계, 이전에 XOLAIR에 노출된 환자의 등록 허용으로 인한 편향(88%), 암 또는 전암성 질환의 병력이 연구 제외 기준인 동안 환자 등록(56%), 높은 연구 중단율(44%)이 포함됩니다.
5.3 급성 천식 증상 및 악화되는 질환
XOLAIR가 급성 천식 악화를 완화하는 것으로 나타나지 않았습니다. 급성 기관지 경련이나 천식 지속 상태를 치료하기 위해 XOLAIR를 사용하지 마십시오. 환자는 XOLAIR로 치료를 시작한 후 천식이 계속 조절되지 않거나 악화되면 의사의 진료를 받아야 합니다.
5.4 Corticosteroid 감량
천식 또는 CRSwNP 치료를 위해 XOLAIR 치료를 시작할 때 전신 또는 흡입 코르티코스테로이드를 갑자기 중단하지 마십시오. 의사의 직접적인 감독 하에 코르티코스테로이드를 점진적으로 줄이십시오. CSU 환자의 경우 코르티코스테로이드와 XOLAIR 병용 사용은 평가되지 않았습니다.
5.5 호산구 증가증
드물게 XOLAIR로 치료받는 천식 환자에서 심각한 전신 호산구 증가증이 나타날 수 있으며, 이는 종종 전신 코르티코스테로이드 요법으로 치료되는 질환인 Churg-Strauss 증후군과 일치하는 혈관염의 임상적 특징을 나타낼 수 있습니다. 이러한 사례는 일반적으로 경구용 코르티코스테로이드 요법의 감량과 관련이 있지만 항상 그런 것은 아닙니다. 의사는 환자에게서 나타나는 호산구 증가증, 혈관염성 발진, 폐 증상 악화, 심장 합병증 및/또는 신경병증에 주의해야 합니다. XOLAIR와 이러한 기저 질환 간의 인과 관계는 확립되지 않았습니다.
5.6 발열, 관절통 및 발진
승인 후 사용에서 일부 환자는 XOLAIR의 첫 번째 주사 또는 후속 주사 후 1~5일 후에 관절염/관절통, 발진, 발열 및 림프절병증을 포함한 일련의 징후 및 증상을 경험했습니다. 이러한 징후 및 증상은 일부 환자에서 추가 용량 투여 후 재발했습니다. 이러한 사례에서 순환 면역 복합체 또는 III형 반응과 일치하는 피부 생검 소견은 나타나지 않았지만, 이러한 징후 및 증상은 혈청병 환자에게서 나타나는 것과 유사합니다. 환자에게 이러한 일련의 징후 및 증상이 나타나면 의사는 XOLAIR 투여를 중단해야 합니다 [부작용 (6.2) 참조].
5.7 기생충(선충) 감염
XOLAIR 요법을 받는 동안 토양 매개 선충 감염 위험이 높은 환자를 모니터링하십시오. XOLAIR 치료 중단 후 토양 매개 선충 감염에 대한 모니터링 기간을 결정할 수 있는 충분한 데이터가 없습니다.
토양 매개 선충(회충, 구충, 편충, 요충) 감염 위험이 높은 성인 및 청소년 환자를 대상으로 브라질에서 실시한 1년간의 임상 시험에서, 표준 대변 검사를 통해 진단된 바와 같이 XOLAIR 치료를 받은 환자의 53%(36/68)가 감염을 경험한 반면, 위약 대조군에서는 42%(29/69)가 감염을 경험했습니다. 감염에 대한 오즈비의 점 추정치는 1.96이었고 95% 신뢰 구간(0.88, 4.36)은 이 연구에서 감염된 환자가 감염되지 않은 환자보다 XOLAIR를 투여받았을 가능성이 0.88~4.36배 더 높았음을 나타냅니다. 대변 알 수로 측정한 적절한 항토양 매개 선충 치료에 대한 반응은 치료군 간에 차이가 없었습니다.
5.8 실험실 검사
XOLAIR:IgE 복합체 형성으로 인해 XOLAIR 투여 후 혈청 총 IgE 수치가 증가합니다 [임상 약리학 (12.2) 참조]. 상승된 혈청 총 IgE 수치는 XOLAIR 중단 후 최대 1년 동안 지속될 수 있습니다. XOLAIR 중단 후 1년 이내에 얻은 혈청 총 IgE 수치는 항정 상태의 유리 IgE 수치를 반영하지 않을 수 있으므로 천식, CRSwNP 또는 IgE 매개 식품 알레르기 환자의 용량 요법을 재평가하는 데 사용하지 마십시오 [용량 및 투여 (2.2, 2.3, 2.4) 참조].
5.9 아나필락시스 응급 치료와 관련된 잠재적 투약 오류
XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에 사용해서는 안 됩니다. 사용을 시뮬레이션한 연구에서 일부 환자와 보호자는 XOLAIR가 아나필락시스를 포함한 알레르기 반응의 응급 치료를 위한 것이 아님을 이해하지 못했습니다. 아나필락시스를 포함한 알레르기 반응의 응급 치료를 위한 XOLAIR의 안전성과 유효성은 확립되지 않았습니다. 환자에게 XOLAIR는 식품 알레르겐을 피하면서 아나필락시스를 포함한 알레르기 반응을 줄이기 위한 유지 요법이라고 알려주십시오.
6 부작용
다음 임상적으로 유의미한 이상 반응은 라벨링의 다른 부분에서 설명되어 있습니다.
- 아나필락시스 [경고 및 주의 사항 (5.1) 및 경고 (BOX) 참조]
- 악성 종양 [경고 및 주의 사항 (5.2) 참조]
6.1 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
성인 및 12세 이상 청소년 천식 환자에서의 임상 연구에서 보고된 이상 반응
아래에 설명된 데이터는 위약 대조군 또는 다른 대조군 천식 연구에서 6개월 동안 노출된 1687명의 환자와 1년 이상 노출된 555명의 환자를 포함하여 12세 이상 성인 및 청소년 환자 2076명에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 환자의 평균 연령은 42세였으며, 65세 이상 환자는 134명이었습니다. 여성은 60%, 백인은 85%였습니다. 환자는 2주 또는 4주마다 XOLAIR 150mg에서 375mg을 투여받았거나, 대조군에 배정된 환자는 위약 유무와 관계없이 표준 치료를 받았습니다.
임상적 개입(예: XOLAIR 중단 또는 이상 반응 치료를 위한 동반 약물 필요)으로 이어지는 가장 흔한 이상 반응은 주사 부위 반응(45%), 바이러스 감염(23%), 상기도 감염(20%), 부비강염(16%), 두통(15%) 및 인후염(11%)이었습니다. 이러한 반응은 XOLAIR 치료 환자와 대조군 환자에서 유사한 비율로 관찰되었습니다.
표 7은 위약 대조군 천식 시험 4건에서 XOLAIR를 투여받은 12세 이상 성인 또는 청소년 환자에서 위약을 투여받은 환자보다 ≥1% 더 자주 발생한 이상 반응을 보여줍니다. 이상 반응은 국제 의학 명명법(IMN) 사전의 선호 용어를 사용하여 분류되었습니다. 주사 부위 반응은 다른 이상 반응 보고와 별도로 기록되었습니다.
| 이상 반응 | XOLAIR n=738 |
위약 n=717 |
|---|---|---|
| 전신 | ||
| 통증 | 7% | 5% |
| 피로 | 3% | 2% |
| 근골격계 | ||
| 관절통 | 8% | 6% |
| 골절 | 2% | 1% |
| 다리 통증 | 4% | 2% |
| 팔 통증 | 2% | 1% |
| 신경계 | ||
| 현기증 | 3% | 2% |
| 피부 및 부속기 | ||
| 가려움증 | 2% | 1% |
| 피부염 | 2% | 1% |
| 특수 감각 | ||
| 귀 통증 | 2% | 1% |
연령(65세 미만 환자), 성별 또는 인종에 따라 유해 반응 발생률에 차이가 없었습니다.
아나필락시스 사례 대조 연구
회귀적 사례 대조 연구는 천식으로 XOLAIR 치료를 받은 환자에서 XOLAIR에 대한 아나필락시스의 위험 요인을 조사했습니다. XOLAIR에 대한 아나필락시스의 심사된 병력이 있는 사례는 그러한 병력이 없는 대조군과 비교되었습니다. 이 연구에 따르면 음식, 약물 또는 기타 원인에 대한 아나필락시스의 자가 보고 병력은 XOLAIR 아나필락시스가 있는 환자(30명 중 57%)에서 대조군(88명 중 23%)보다 더 흔했습니다[OR 8.1, 95% CI 2.7 to 24.3]. 이것은 사례 대조 연구이기 때문에 XOLAIR 사용자에서 아나필락시스 발생률을 제공할 수 없습니다. 다른 출처에서 XOLAIR에 대한 아나필락시스는 임상 시험에서 환자의 0.1%에서, 시판 후 보고에 따르면 환자의 최소 0.2%에서 관찰되었습니다. 사례의 약 60%에서 70%가 XOLAIR의 처음 3회 투여 내에 발생한 것으로 보고되었으며, 추가 사례는 3회 투여 후 산발적으로 발생했습니다. 아나필락시스 발병 시간은 대부분의 사례(약 75%)에서 2시간 이내에 발생한 것으로 보고되었습니다. [경고 및 주의 사항(5.1), 유해 반응(6.2) 참조].
주사 부위 반응
성인 및 청소년의 경우, 모든 중증도의 주사 부위 반응은 XOLAIR 치료를 받은 환자의 45%에서 위약 치료를 받은 환자의 43%에 비해 발생했습니다. 주사 부위 반응의 유형은 다음과 같습니다. 멍, 발적, 열감, 화끈거림, 따끔거림, 가려움증, 두드러기 형성, 통증, 경화, 덩어리 및 염증.
중증 주사 부위 반응은 XOLAIR 치료를 받은 환자에서 위약군 환자에 비해 더 자주 발생했습니다(12% 대 9%).
대부분의 주사 부위 반응은 주사 후 1시간 이내에 발생했고, 8일 미만 지속되었으며, 일반적으로 후속 투여 방문 시 빈도가 감소했습니다.
소아 환자(6세 이상 <12세 미만)에서 천식에 대한 임상 연구의 유해 반응
아래에 설명된 데이터는 위약 대조 또는 기타 대조 천식 연구에서 6세 이상 <12세 미만의 환자 926명(6개월 동안 노출된 환자 583명, 1년 이상 노출된 환자 292명 포함)에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 소아 환자의 평균 연령은 8.8세였으며, 69%가 남성이었고, 64%가 백인이었습니다. 소아 환자는 2주 또는 4주마다 XOLAIR 75mg에서 375mg을 투여받았거나, 대조군에 배정된 환자는 위약 유무와 관계없이 표준 치료를 받았습니다. 이러한 시험에서 XOLAIR로 치료받은 환자에서 악성 종양 사례는 보고되지 않았습니다.
XOLAIR를 투여받은 소아 환자에서 3% 이상 발생했고 위약 치료를 받은 환자보다 더 자주 발생한 가장 흔한 유해 반응은 비인두염, 두통, 발열, 상복부 통증, 연쇄상 구균 인두염, 중이염, 바이러스성 위장염, 절지동물 물림, 코피였습니다.
임상적 개입(예: XOLAIR 중단 또는 유해 사건 치료를 위한 동반 약물 필요)으로 이어지는 가장 흔한 유해 반응은 기관지염(0.2%), 두통(0.2%) 및 두드러기(0.2%)였습니다. 이러한 반응은 XOLAIR 치료를 받은 환자와 대조군 환자에서 유사한 비율로 관찰되었습니다.
성인 환자에서 비강 용종을 동반한 만성 비부비동염에 대한 임상 연구의 유해 반응
아래에 설명된 데이터는 두 개의 위약 대조 연구에서 6개월 동안 노출된 18세 이상의 환자 135명에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 환자의 평균 연령은 49.7세였으며, 64%가 남성이었고, 94%가 백인이었습니다. 환자는 표 3에 따라 용량과 빈도를 조정하여 2주 또는 4주마다 XOLAIR 또는 위약을 SC로 투여받았습니다. 모든 환자는 연구 기간 동안 배경 비강 모메타손 치료를 받았습니다. 표 8은 비강 용종을 동반한 만성 비부비동염(CRSwNP) 시험 1 및 2에서 XOLAIR 치료를 받은 환자의 3% 이상 발생했고 위약 치료를 받은 환자보다 더 자주 발생한 유해 반응을 나열합니다. 결과는 풀링되었습니다.
| 유해 반응 | XOLAIR n=135 |
위약 n=130 |
|---|---|---|
| CRSwNP = 비강 용종을 동반한 만성 비부비동염. | ||
|
||
| 위장 장애 | ||
| 상복부 통증 | 4 (3.0%) | 1 (0.8%) |
| 일반 장애 및 투여 부위 상태 | ||
| 주사 부위 반응* | 7 (5.2%) | 2 (1.5%) |
| 근골격계 및 결합 조직 장애 | ||
| 관절통 | 4 (3.0%) | 2 (1.5%) |
| 신경계 장애 | ||
| 두통 | 11 (8.1%) | 7 (5.4%) |
| 현기증 | 4 (3.0%) | 1 (0.8%) |
IgE 매개 식품 알레르기 환자의 임상 연구에서 나타난 이상 반응
XOLAIR의 안전성은 아나필락시스를 포함한 IgE 매개 알레르기 반응(I형)이 한 가지 이상의 식품에 우연히 노출되어 발생할 수 있는 환자에서 평가되었으며, 이는 168명의 환자(소아 환자 165명 및 성인 3명)를 대상으로 한 식품 알레르기(FA) 시험의 데이터를 기반으로 했습니다. 이 시험은 무작위 배정, 이중 맹검, 위약 대조 시험으로, 참가자들은 땅콩과 두 가지 이상의 다른 식품에 알레르기가 있었습니다 [임상 연구(14.3) 참조]. 환자들은 치료 시작 전에 측정한 IgE 수치(IU/mL)와 표 4 [투여량 및 투여 방법(2.4) 참조]에 제시된 체중(kg)에 따라 권장 용량으로 16~20주 동안 2주 또는 4주마다 XOLAIR 또는 위약을 피하 주사로 투여받았습니다. 표 9에 제시된 안전성 데이터는 1세에서 17세 사이의 소아 환자를 대상으로 한 주요 분석 모집단에서 얻은 것입니다. 이 시험에서 성인(n=3)으로부터 얻은 안전성 데이터는 제한적이었습니다. 표 9에는 FA 시험에서 XOLAIR로 치료받은 소아 환자의 3% 이상에서 발생했고 위약으로 치료받은 환자보다 더 자주 발생한 이상 반응이 나열되어 있습니다. 이상 반응으로 인한 치료 중단은 없었습니다.
| 이상 반응 | XOLAIR n=110 |
위약 n=55 |
|---|---|---|
|
||
| 일반적인 장애 및 투여 부위 상태 | ||
| 주사 부위 반응* | 17 (15.5%) | 6 (10.9%) |
| 발열 | 7 (6.4%) | 2 (3.6%) |
만성 자발성 두드러기 환자에서 임상 연구로부터 보고된 이상 반응
XOLAIR의 만성 자발성 두드러기(CSU) 치료에 대한 안전성은 12주(CSU 시험 2) 및 24주(CSU 시험 1 및 3) 기간의 위약 대조, 다중 투여 임상 시험 3건에서 평가되었습니다. CSU 시험 1 및 2에서 환자는 치료 기간 동안 기저 수준의 H1 항히스타민 요법에 더하여 4주마다 XOLAIR 75mg, 150mg 또는 300mg 또는 위약을 투여받았습니다. CSU 시험 3에서 환자는 기저 수준의 H1 항히스타민 요법에 더하여 4주마다 XOLAIR 300mg 또는 위약을 무작위 배정받았습니다. 아래에 설명된 데이터는 3건의 임상 시험에서 XOLAIR를 최소 1회 투여받고 등록된 733명의 환자(12주 동안 노출된 환자 684명, 24주 동안 노출된 환자 427명 포함)에 대한 XOLAIR 노출을 반영합니다. XOLAIR 300mg을 투여받은 환자의 평균 연령은 43세였으며, 75%가 여성이었고, 89%가 백인이었습니다. XOLAIR 150mg 및 75mg을 투여받은 환자의 인구 통계적 특성은 유사했습니다.
표 10은 XOLAIR(150mg 또는 300mg)를 투여받은 환자의 2% 이상에서 발생하고 위약을 투여받은 환자보다 더 빈번하게 발생한 이상 반응을 보여줍니다. 이상 반응은 CSU 시험 2와 CSU 시험 1 및 3의 첫 12주에서 풀링되었습니다.
| 이상 반응* | CSU 시험 1, 2 및 3 풀링 | ||
|---|---|---|---|
| 150mg (n=175) |
300mg (n=412) |
위약 (n=242) |
|
|
|||
| 위장 장애 | |||
| 메스꺼움 | 2 (1.1%) | 11 (2.7%) | 6 (2.5%) |
| 감염 및 기생충 감염 | |||
| 비인두염 | 16 (9.1%) | 27 (6.6%) | 17 (7.0%) |
| 축농증 | 2 (1.1%) | 20 (4.9%) | 5 (2.1%) |
| 상기도 감염 | 2 (1.1%) | 14 (3.4%) | 5 (2.1%) |
| 바이러스성 상기도 감염 | 4 (2.3%) | 2 (0.5%) | (0.0%) |
| 근골격계 및 결합 조직 장애 | |||
| 관절통 | 5 (2.9%) | 12 (2.9%) | 1 (0.4%) |
| 신경계 장애 | |||
| 두통 | 21 (12.0%) | 25 (6.1%) | 7 (2.9%) |
| 호흡기, 흉곽 및 종격 장애 | |||
| 기침 | 2 (1.1%) | 9 (2.2%) | 3 (1.2%) |
CSU 시험 1 및 3에서 24주 치료 기간 동안 보고된 추가 반응 [XOLAIR (150mg 또는 300mg)를 투여받은 환자의 ≥2% 및 위약을 투여받은 환자보다 빈번하게]에는 다음이 포함되었습니다. 치통, 진균 감염, 요로 감염, 근육통, 사지 통증, 근골격계 통증, 말초 부종, 발열, 편두통, 부비동 두통, 불안, 인후통, 천식, 두드러기 및 탈모.
천식 환자의 임상 연구에서 발생한 심혈관 및 뇌혈관 사건
악성 종양 위험을 포함하여 XOLAIR의 장기 안전성을 평가하기 위해 다년생 공기 알레르겐에 대한 양성 피부 반응 검사를 보인 중등도에서 중증의 지속적인 천식이 있는 12세 이상의 환자를 대상으로 5년 관찰 코호트 연구가 수행되었습니다. [경고 및 주의 사항 (5.2) 참조]. 총 5007명의 XOLAIR 치료 환자와 2829명의 비 XOLAIR 치료 환자가 연구에 등록되었습니다. 두 코호트 모두에서 유사한 비율의 환자가 현재 흡연자 (5%) 또는 과거 흡연자 (29%)였습니다. 환자의 평균 연령은 45세였으며 평균 3.7년 동안 추적 관찰되었습니다. XOLAIR 치료 환자는 비 XOLAIR 치료 환자 (23%)에 비해 중증 천식으로 진단받은 비율이 더 높았으며 (50%), 환자의 44%가 연구를 조기에 중단했습니다. 또한 XOLAIR 치료 코호트의 환자 중 88%는 이전에 평균 8개월 동안 XOLAIR에 노출된 적이 있었습니다.
XOLAIR 치료 환자에서 비 XOLAIR 치료 환자 (8.1)에 비해 전체 심혈관 및 뇌혈관 중증 유해 사건 (SAE)의 발생률 (1000 환자-년당)이 더 높았습니다. 일과성 허혈 발작 (0.7 대 0.1), 심근 경색 (2.1 대 0.8), 폐 고혈압 (0.5 대 0), 폐색전증/정맥 혈전증 (3.2 대 1.5) 및 불안정 협심증 (2.2 대 1.4)의 비율이 증가한 반면, 허혈성 뇌졸중 및 심혈관 사망의 비율은 두 연구 코호트 모두에서 유사했습니다. 결과는 XOLAIR로 치료받은 환자에서 심각한 심혈관 및 뇌혈관 사건의 위험이 증가할 가능성을 시사합니다. 그러나 관찰 연구 설계, 이전에 XOLAIR에 노출된 환자 (88%) 포함, 치료 그룹 간 심혈관 위험 요인의 기준선 불균형, 측정되지 않은 위험 요인에 대한 조정 불가능 및 높은 연구 중단율은 위험의 규모를 정량화하는 능력을 제한합니다.
8주에서 52주까지 지속되는 25건의 무작위 이중 맹검 위약 대조 임상 시험의 풀링 분석을 통해 위의 관찰 코호트 연구에서 언급된 심혈관 및 뇌혈관 SAE의 불균형을 추가로 평가했습니다. 총 3342명의 XOLAIR 치료 환자와 2895명의 위약 치료 환자가 풀링 분석에 포함되었습니다. 환자의 평균 연령은 38세였으며 평균 6.8개월 동안 추적 관찰되었습니다. 위에 나열된 심혈관 및 뇌혈관 SAE의 비율에서 주목할 만한 불균형은 관찰되지 않았습니다. 그러나 풀링 분석의 결과는 관찰 코호트 연구보다 적은 수의 사건, 약간 젊은 환자 및 더 짧은 추적 관찰 기간을 기반으로 했기 때문에 결과는 관찰 코호트 연구에서 언급된 결과를 확인하거나 거부하기에 충분하지 않습니다.
6.2 시판 후 경험
다음 유해 반응은 XOLAIR의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
아나필락시스: 자발적 보고 및 2003년 6월부터 2006년 12월까지 추정되는 약 57,300명의 환자 노출을 기반으로 XOLAIR 사용으로 인한 아나필락시스 빈도는 환자의 최소 0.2%로 추정되었습니다.
아나필락시스의 진단 기준은 피부 또는 점막 조직의 관여와 기도 폐쇄 및/또는 혈압 감소를 동반하거나 동반하지 않은 증상, 그리고 XOLAIR 투여와의 시간적 관계와 다른 식별 가능한 원인이 없었습니다. 이러한 보고된 사례에서 나타나는 징후 및 증상에는 기관지 경련, 저혈압, 실신, 두드러기, 목이나 혀의 혈관 부종, 호흡 곤란, 기침, 가슴 답답함 및/또는 피부 혈관 부종이 포함되었습니다. 폐 관여는 사례의 89%에서 보고되었습니다. 저혈압 또는 실신은 사례의 14%에서 보고되었습니다. 보고된 사례의 15%가 입원으로 이어졌습니다. XOLAIR와 관련 없는 아나필락시스의 과거력은 사례의 24%에서 보고되었습니다.
보고된 XOLAIR 관련 아나필락시스 사례 중 39%는 첫 번째 투여 시 발생했고, 19%는 두 번째 투여 시, 10%는 세 번째 투여 시 발생했으며, 나머지는 그 이후 투여 시 발생했습니다. 한 사례는 39회 투여 후(19개월 연속 치료 후, 3개월 간격으로 치료를 재개했을 때 아나필락시스 발생)에 발생했습니다. 이러한 사례에서 아나필락시스 발병까지의 시간은 35%에서 최대 30분, 16%에서 30분 초과 60분 이하, 2%에서 60분 초과 90분 이하, 6%에서 90분 초과 120분 이하, 5%에서 2시간 초과 6시간 이하, 14%에서 6시간 초과 12시간 이하, 8%에서 12시간 초과 24시간 이하, 5%에서 24시간 초과 4일 이하였습니다. 9%의 사례에서는 발병까지의 시간을 알 수 없었습니다.
아나필락시스를 경험한 23명의 환자에게 XOLAIR를 재투여했고, 18명의 환자에서 유사한 아나필락시스 증상이 재발했습니다. 또한, 이전에 두드러기만 경험했던 4명의 환자에서 XOLAIR 재투여 시 아나필락시스가 발생했습니다.
호산구성 질환: 호산구성 질환이 보고되었습니다 [경고 및 주의 사항 (5.5) 참조].
발열, 관절통 및 발진: XOLAIR의 시판 후 사용에서 혈청병과 유사한 관절염/관절통, 발진(두드러기 또는 기타 형태), 발열 및 림프절 종대를 포함한 증상 및 징후가 보고되었습니다 [경고 및 주의 사항 (5.6) 참조].
7 약물 상호작용
XOLAIR와의 공식적인 약물 상호 작용 연구는 수행되지 않았습니다.
천식, 비강용종을 동반한 만성 부비동염, IgE 매개 식품 알레르기 환자에서 XOLAIR와 알레르기 면역 요법의 병용 사용은 평가되지 않았습니다.
CSU 환자에서 XOLAIR를 면역 억제 요법과 병용하여 사용한 연구는 없습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 중 XOLAIR 노출에 대한 레지스트리 연구에서 주요 선천적 기형 또는 유산율이 증가하지 않았습니다. 출생 시 평균 임신 기간에도 불구하고 레지스트리 영아에서 저체중 출생률이 다른 코호트의 영아에 비해 증가했지만, 임신 중 XOLAIR를 복용한 여성은 또한 더 심각한 천식을 앓고 있어 저체중 출생이 약물 때문인지 질병 심각도 때문인지 판단하기 어렵습니다 [데이터 참조]. 임신 중 천식이 잘 조절되지 않거나 중등도로 조절되지 않으면 위험이 따릅니다 [임상적 고려 사항 참조].
인간 IgG 항체는 태반 장벽을 통과하는 것으로 알려져 있습니다. 따라서 XOLAIR는 모체에서 태아로 전달될 수 있습니다.
동물 생식 연구에서, 최대 권장 인체 용량(MRHD)의 약 5배에 해당하는 피하 투여량의 오말리주맙을 투여한 시노몰구스 원숭이에서 태아에 대한 유해성 증거가 관찰되지 않았습니다 [데이터 참조].
지정된 모집단(들)에 대한 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
데이터
인간 데이터
2006년부터 2018년까지 미국에서 실시된 전향적 코호트 임신 노출 레지스트리 연구에는 XOLAIR로 치료받은 천식이 있는 임산부 250명이 포함되었습니다. 이 중 246명의 환자가 임신 1분기에 XOLAIR에 노출되었으며, 중간 노출 기간은 8.7개월이었습니다.
해당 모체 및 영아 하위 그룹에 대한 레지스트리 결과는 캐나다 퀘벡 주 거주자의 의료 데이터베이스에서 확인된 XOLAIR에 노출되지 않은 천식이 있는 임산부 1,153명의 질병 일치 외부 코호트(퀘벡 외부 비교 코호트(“비교 코호트”)라고 함)에서 연령 조정 빈도와 비교되었습니다.
해당 레지스트리 영아 중 주요 선천적 기형의 유병률(8.1%)은 비교 코호트의 영아(8.9%)와 유사했습니다. 해당 레지스트리 임신 중 99.1%가 생존 출산으로 이어졌으며, 이는 비교 코호트의 99.3%와 유사합니다. 레지스트리 영아에서 저체중 출생률이 증가했습니다(13.7%). 그러나 임신 중 XOLAIR를 복용한 여성은 또한 더 심각한 천식을 앓고 있어 저체중 출생이 약물 때문인지 질병 심각도 때문인지 판단하기 어렵습니다.
레지스트리 연구는 레지스트리의 관찰적 성격, 작은 표본 크기 및 레지스트리 모집단과 비교 코호트 간의 잠재적 차이를 포함한 방법론적 제한으로 인해 어떤 위험도 없다는 것을 확실하게 입증할 수 없습니다.
8.2 수유
위험 요약
모유에서 오말리주맙의 존재 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다. 그러나 오말리주맙은 인간 단일클론 항체(IgG1 카파)이며, 면역 글로불린(IgG)은 소량으로 모유에 존재합니다.
임신 노출 레지스트리에서 영아의 대부분(80.9%, 186/230)은 모유 수유를 받았습니다. “감염 및 기생충”으로 분류된 사건은 모유 수유를 통해 XOLAIR에 노출된 영아에서 모유 수유를 하지 않은 영아 또는 XOLAIR에 노출되지 않고 모유 수유를 한 영아에 비해 유의하게 증가하지 않았습니다.
모유 수유의 발달적 및 건강상 이점은 모체의 XOLAIR에 대한 임상적 필요성과 오말리주맙 또는 기저 모체 질환으로 인한 모유 수유 아동에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
천식
XOLAIR의 안전성 및 유효성은 다년생 항원에 대한 피부 반응 검사 또는 체외 반응성이 양성이고 흡입용 코르티코스테로이드로 증상이 적절히 조절되지 않는 중등도에서 중증의 지속적인 천식을 가진 6세 이상의 소아 환자에서 확립되었습니다. 이 적응증에 대한 XOLAIR의 사용은 적절하고 잘 통제된 연구에서 얻은 증거에 의해 뒷받침됩니다. XOLAIR는 다년생 항원에 대한 피부 반응 검사 또는 체외 반응성이 양성이고 중등도에서 중증의 지속적인 천식을 가진 6세에서 <12세의 소아 환자 926명(XOLAIR 624명, 위약 302명)을 대상으로 한 2건의 임상 시험에서 평가되었습니다. 한 임상 시험은 성인 및 청소년 천식 임상 시험 1 및 2와 유사한 설계 및 수행으로 이루어진 주요 임상 시험이었습니다. 다른 임상 시험은 주로 안전성 연구였으며 효능을 2차 결과로 평가했습니다. 주요 임상 시험에서 XOLAIR 치료 환자는 악화율이 통계적으로 유의하게 감소했습니다(악화는 전신 코르티코스테로이드 치료가 필요하거나 기저 ICS 용량이 2배로 증가하는 천식 악화로 정의됨) [임상 연구(14.1) 참조].
6세 미만의 소아 천식 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
IgE 매개 식품 알레르기
우발적인 한 가지 이상의 식품 노출로 인해 발생할 수 있는 알레르기 반응(I형), 포함하여 아나필락시스를 감소시키기 위한 XOLAIR의 안전성 및 유효성은 IgE 매개 식품 알레르기를 가진 1세 이상의 소아 환자에서 확립되었습니다. 이 적응증에 대한 XOLAIR의 사용은 총 165명의 소아 환자(1세에서 6세 미만의 환자 61명, 6세에서 18세 미만의 환자 104명)를 포함한 적절하고 잘 통제된 연구에서 얻은 증거에 의해 뒷받침됩니다. 위약 치료 환자에 비해 XOLAIR 치료 환자에서 용량 제한 증상 없이 단일 식품(땅콩, 캐슈넛, 우유, 계란)을 섭취할 수 있는 비율이 유의하게 높았습니다 [임상 연구(14.3) 참조].
1세 미만의 IgE 매개 식품 알레르기를 가진 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
만성 자발성 두드러기
H1 항히스타민제 치료에도 불구하고 증상이 지속되는 만성 자발성 두드러기(CSU)를 가진 12세 이상의 소아 환자에 대한 XOLAIR의 안전성 및 유효성은 확립되었습니다. 이 인구 집단에서 XOLAIR의 사용은 적절하고 잘 통제된 연구에서 얻은 증거에 의해 뒷받침됩니다. CSU를 가진 청소년 환자는 3건의 무작위 배정, 위약 대조 CSU 임상 시험에 포함된 12세에서 17세의 환자 39명(XOLAIR 29명, 위약 10명)을 대상으로 평가했습니다. 주간 가려움증 점수가 수치적으로 감소했으며, 이상 반응은 18세 이상의 환자에서 보고된 것과 유사했습니다.
12세 미만의 CSU를 가진 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
임상 연구에서 65세 이상의 천식 환자 134명, CRSwNP 환자 20명, CSU 환자 37명, IgE 매개 식품 알레르기 환자 0명이 XOLAIR로 치료를 받았습니다. 이러한 연구에서 연령 관련 차이가 분명하게 관찰되지 않았지만, 65세 이상의 환자 수가 충분하지 않아 이들이 젊은 환자와 다르게 반응하는지 여부를 판단할 수 없습니다.
11 설명
오말리주맙은 재조합 DNA 유래 인간화 IgG1κ 단클론 항체로, 인간 면역글로불린 E(IgE)에 선택적으로 결합합니다. 이 항체의 분자량은 약 149 킬로달톤입니다. XOLAIR는 중국 햄스터 난소 세포 현탁 배양에 의해 생산됩니다.
XOLAIR(오말리주맙)는 피하(SC) 주사로 투여되며, 미리 채워진 주사기, 자동 주사기 및 바이알로 제공됩니다.
XOLAIR 주사제(미리 채워진 주사기 또는 자동 주사기)
XOLAIR(오말리주맙) 주사제는 피하 주사용 무균, 방부제 무첨가, 투명 또는 약간 불투명하고 무색에서 옅은 갈색을 띠는 용액으로 제공됩니다. XOLAIR(오말리주맙) 주사제는 단회용 미리 채워진 주사기 또는 단회용 자동 주사기로 제공됩니다.
75mg 미리 채워진 주사기 또는 자동 주사기 각각은 0.5mL에 오말리주맙 75mg을 함유하며, 아르기닌 염산염(21.05mg), 히스티딘(0.68mg), L-히스티딘 염산염 일수화물(1.17mg) 및 폴리소르베이트 20(0.2mg)을 주사용 무균수(SWFI), USP에 함유하고 있습니다.
150mg 미리 채워진 주사기 또는 자동 주사기 각각은 1mL에 오말리주맙 150mg을 함유하며, 아르기닌 염산염(42.1mg), 히스티딘(1.37mg), L-히스티딘 염산염 일수화물(2.34mg) 및 폴리소르베이트 20(0.4mg)을 SWFI, USP에 함유하고 있습니다.
300mg 미리 채워진 주사기 또는 자동 주사기 각각은 2mL에 오말리주맙 300mg을 함유하며, 아르기닌 염산염(84.2mg), 히스티딘(2.74mg), L-히스티딘 염산염 일수화물(4.68mg) 및 폴리소르베이트 20(0.8mg)을 SWFI, USP에 함유하고 있습니다.
26게이지 고정 바늘이 장착된 XOLAIR 75mg/0.5mL 및 150mg/mL 미리 채워진 주사기의 바늘 캡은 천연 고무 라텍스 유도체를 함유하고 있으며, 라텍스에 민감한 개인에게 알레르기 반응을 일으킬 수 있습니다 [제공 형태/보관 및 취급(16) 참조].
XOLAIR 자동 주사기는 천연 고무 라텍스로 만들어지지 않았습니다.
주사용 XOLAIR(바이알)
주사용 XOLAIR(오말리주맙)는 단회용 바이알에 무균, 백색, 방부제 무첨가, 동결 건조된 분말로 제공됩니다. 주사용 무균수, USP 1.4mL로 재구성한 후, 바이알은 피하 주사용 재구성된 용액 1.2mL당 오말리주맙 150mg을 함유합니다. 재구성된 용액 1.2mL 각각은 히스티딘(1.3mg), L-히스티딘 염산염 일수화물(2.1mg), 폴리소르베이트 20(0.4mg) 및 수크로스(108mg)를 함유하고 있습니다.
12 임상약리학
12.1 작용 기전
12.2 약력학
천식
임상 연구에서, 혈청 유리 IgE 수치는 첫 번째 용량 투여 후 1시간 이내에 용량 의존적으로 감소했으며 용량 간에 유지되었습니다. 권장 용량을 사용했을 때 평균 혈청 유리 IgE 감소율은 96%를 초과했습니다. 유리 IgE에 비해 제거 속도가 느린 오말리주맙:IgE 복합체 형성으로 인해 첫 번째 용량 투여 후 혈청 총 IgE 수치(즉, 결합 및 비결합)가 증가했습니다. 첫 번째 용량 투여 후 16주째에 표준 분석법을 사용했을 때 평균 혈청 총 IgE 수치는 치료 전에 비해 5배 높았습니다. XOLAIR 투여 중단 후, 총 IgE의 XOLAIR에 의한 증가 및 유리 IgE의 감소는 가역적이었으며, 약물 제거 후 IgE 수치의 반등은 관찰되지 않았습니다. 총 IgE 수치는 XOLAIR 중단 후 최대 1년 동안 치료 전 수치로 돌아오지 않았습니다.
비폴립을 동반한 만성 비부비동염
비폴립을 동반한 만성 비부비동염(CRSwNP) 환자를 대상으로 한 임상 연구에서, 오말리주맙 치료는 천식 환자에서 관찰된 것과 유사하게 혈청 유리 IgE의 감소 및 혈청 총 IgE 수치의 증가를 유발했습니다. 기준점에서 평균 총 IgE 농도는 CRSwNP 1상 시험에서 168IU/mL, CRSwNP 2상 시험에서 218IU/mL였습니다. 표 3에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 투여 전 평균 유리 IgE 농도는 CRSwNP 1상 시험에서 10.0IU/mL, CRSwNP 2상 시험에서 11.7IU/mL였으며 24주 치료 시까지 안정적으로 유지되었습니다. 유리 IgE에 비해 제거 속도가 느린 오말리주맙-IgE 복합체 형성으로 인해 혈청 내 총 IgE 수치가 증가했습니다. 표 3에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 투여 전 평균 및 중앙값 혈청 총 IgE 수치는 치료 전 수치에 비해 3~4배 높았으며 16주에서 24주 치료 시까지 안정적으로 유지되었습니다.
IgE 매개성 식품 알레르기
IgE 매개성 식품 알레르기 환자를 대상으로 한 임상 연구에서, 오말리주맙 치료는 천식 환자에서 관찰된 것과 유사하게 혈청 유리 IgE의 감소 및 혈청 총 IgE 수치의 증가를 유발했습니다. 기준점에서 평균 총 IgE 농도는 810IU/mL였습니다. 표 4에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 투여 전 평균 유리 IgE 농도는 10.0IU/mL였습니다. 유리 IgE에 비해 반감기가 긴 오말리주맙-IgE 복합체 형성으로 인해 혈청 내 평균 총 IgE 수치가 약 2.4배 증가했습니다.
만성 특발성 두드러기
만성 특발성 두드러기(CSU) 환자를 대상으로 한 임상 연구에서, XOLAIR 치료는 천식 환자에서 관찰된 것과 유사하게 용량 의존적으로 혈청 유리 IgE의 감소 및 혈청 총 IgE 수치의 증가를 유발했습니다. 유리 IgE의 최대 억제는 첫 번째 피하 용량 투여 후 3일째에 관찰되었습니다. 4주마다 1회 반복 투여한 후, 투여 전 혈청 유리 IgE 수치는 12주에서 24주 치료 시까지 안정적으로 유지되었습니다. 유리 IgE에 비해 제거 속도가 느린 오말리주맙-IgE 복합체 형성으로 인해 첫 번째 용량 투여 후 혈청 내 총 IgE 수치가 증가했습니다. 4주마다 1회 75mg~300mg을 반복 투여한 후, 12주차의 투여 전 평균 혈청 총 IgE 수치는 치료 전 수치에 비해 2~3배 높았으며 12주에서 24주 치료 시까지 안정적으로 유지되었습니다. XOLAIR 투여 중단 후, 유리 IgE 수치는 증가했고 총 IgE 수치는 16주 추적 관찰 기간 동안 치료 전 수치를 향해 감소했습니다.
12.3 약동학
피하 투여 후, 오말리주맙은 평균 62%의 절대 생체 이용률로 흡수되었습니다. 천식이 있는 성인 및 청소년 환자에게 단일 피하 용량을 투여한 후, 오말리주맙은 천천히 흡수되어 평균 7~8일 후에 최고 혈청 농도에 도달했습니다. CSU 환자의 경우, 단일 피하 용량 투여 후 유사한 시간에 최고 혈청 농도에 도달했습니다. 오말리주맙의 약동학은 0.5mg/kg을 초과하는 용량에서 선형적이었습니다. 천식 환자가 여러 용량의 XOLAIR를 투여받은 후, 정상 상태에서 0일차부터 14일차까지 혈청 농도-시간 곡선 아래 면적은 첫 번째 용량 투여 후보다 최대 6배 높았습니다. CSU 환자의 경우, 오말리주맙은 75mg~600mg의 용량 범위에서 단일 피하 용량으로 투여했을 때 선형 약동학을 보였습니다. 4주마다 75mg~300mg을 반복 투여한 후, 오말리주맙의 최저 혈청 농도는 용량 수준에 비례하여 증가했습니다.
In vitro, omalizumab formed complexes of limited size with IgE. Precipitating complexes and complexes larger than 1 million daltons in molecular weight were not observed in vitro or in vivo. Tissue distribution studies in Cynomolgus monkeys showed no specific uptake of 125I-omalizumab by any organ or tissue. The apparent volume of distribution of omalizumab in patients with asthma following SC administration was 78 ± 32 mL/kg. In patients with CSU, based on population pharmacokinetics, distribution of omalizumab was similar to that in patients with asthma.
Clearance of omalizumab involved IgG clearance processes as well as clearance via specific binding and complex formation with its target ligand, IgE. Liver elimination of IgG included degradation in the liver reticuloendothelial system (RES) and endothelial cells. Intact IgG was also excreted in bile. In studies with mice and monkeys, omalizumab:IgE complexes were eliminated by interactions with Fcγ receptors within the RES at rates that were generally faster than IgG clearance. In asthma patients omalizumab serum elimination half-life averaged 26 days, with apparent clearance averaging 2.4 ± 1.1 mL/kg/day. Doubling body weight approximately doubled apparent clearance. In CSU patients, at steady state, based on population pharmacokinetics, omalizumab serum elimination half-life averaged 24 days and apparent clearance averaged 240 mL/day (corresponding to 3.0 mL/kg/day for an 80 kg patient).
특정 집단
천식
천식 환자에서 인구 통계학적 특징의 영향을 평가하기 위해 오말리주맙의 모집단 약동학을 분석했습니다. 이러한 데이터 분석 결과 연령(6~76세), 인종, 민족 또는 성별에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다.
비용종을 동반한 만성 부비동염
오말리주맙의 모집단 약동학 분석 결과 비용종을 동반한 만성 부비동염(CRSwNP)에서 오말리주맙의 약동학은 천식 환자의 약동학과 일치하는 것으로 나타났습니다. 인구 통계학적 특징 및 기타 요인이 오말리주맙 노출 및 임상 반응에 미치는 영향을 평가하기 위해 그래픽 공변량 분석을 수행했습니다. 이러한 분석 결과 연령(18~75세) 또는 성별에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다. CRSwNP 연구에서는 인종 및 민족 데이터가 너무 제한적이어서 용량 조절에 대한 정보를 제공할 수 없습니다.
12.6 면역원성
관찰된 항의약품 항체 발생률은 검사의 민감도 및 특이도에 따라 크게 달라집니다. 검사 방법의 차이로 인해 아래에 설명된 연구에서 항의약품 항체 발생률을 XOLAIR 또는 기타 오말리주맙 제품 연구를 포함한 다른 연구의 항의약품 항체 발생률과 의미 있게 비교할 수 없습니다.
12세 이상 환자의 천식에 대해 평가된 임상 연구에서 XOLAIR로 치료받은 환자 1/1723명 미만(<0.1%)에서 XOLAIR에 대한 항체가 검출되었습니다. 세 건의 소아 연구에서 XOLAIR로 치료받고 항체를 평가받은 6세 미만 ~ 12세 미만 환자 581명 중 1명에게서 XOLAIR에 대한 항체가 검출되었습니다. CSU 임상 시험에서 치료받은 환자에게서는 검출 가능한 항체가 없었지만, 항치료 항체 샘플링 시점의 XOLAIR 수치와 일부 환자의 누락된 샘플로 인해 이러한 임상 연구에서 치료받은 733명의 환자 중 88%만 XOLAIR에 대한 항체를 확인할 수 있었습니다. 데이터는 ELISA 검사에서 XOLAIR에 대한 항체 양성으로 간주된 환자의 비율을 반영하며 검사의 민감도 및 특이도에 따라 크게 달라집니다.
CRSwNP 또는 IgE 매개 식품 알레르기 시험에서는 항의약품 항체를 측정하지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
XOLAIR의 발암 가능성을 평가하기 위한 장기 동물 연구는 수행되지 않았습니다.
XOLAIR를 피하 주사로 최대 75 mg/kg/주(mg/kg 기준으로 최대 권장 인간 용량의 약 5배)까지 투여한 수컷 및 암컷 붉은털원숭이에서 생식력 및 생식 능력에 대한 영향은 관찰되지 않았습니다.
14 임상 연구
14.1 천식
12세 이상의 성인 및 청소년 환자
세 건의 무작위 배정, 이중맹검, 위약 대조, 다기관 시험에서 XOLAIR의 안전성 및 유효성을 평가했습니다.
이 시험에는 최소 1년 동안 중증도에서 중증의 지속성 천식(NHLBI 기준)이 있고 다년생 공기 알레르겐에 대한 피부 검사 반응이 양성인 12~76세의 환자가 등록되었습니다. 모든 시험에서 XOLAIR 용량은 체중과 기준 혈청 총 IgE 농도를 기준으로 했습니다. 모든 환자는 기준선 IgE가 30~700IU/mL이고 체중이 150kg 이하여야 했습니다. 환자는 4주마다 최소 0.016mg/kg/IU(IgE/mL)의 XOLAIR 또는 이에 상응하는 용량의 위약을 투여하는 용량표에 따라 치료를 받았습니다. 4주당 최대 XOLAIR 용량은 750mg이었습니다.
세 가지 시험 모두에서 악화는 전신 코르티코스테로이드 치료 또는 기준 ICS 용량의 두 배 증량이 필요한 천식 악화로 정의되었습니다. 대부분의 악화는 외래 환자 환경에서 관리되었으며 대다수는 전신 스테로이드로 치료되었습니다. 입원율은 XOLAIR 치료 환자와 위약 치료 환자 간에 유의미한 차이가 없었습니다. 그러나 전체 입원율은 낮았습니다. 악화를 경험한 환자 중 악화 중증도 분포는 치료군 간에 유사했습니다.
천식 시험 1 및 2
스크리닝 시 천식 시험 1 및 2의 환자는 1초간 강제 호기량(FEV1)이 예상 값의 40%~80%였습니다. 모든 환자는 베타2-작용제 투여 후 FEV1이 최소 12% 개선되었습니다. 모든 환자는 증상이 있었고 흡입 코르티코스테로이드(ICS)와 속효성 베타2-작용제로 치료를 받고 있었습니다. 다른 병용 조절제를 투여받는 환자는 제외되었으며, 연구 중 추가 조절제의 시작은 금지되었습니다. 현재 흡연 중인 환자는 제외되었습니다.
각 시험은 공통 ICS(베클로메타손 디프로피오네이트)로 안정적으로 전환하기 위한 실행 기간으로 구성되었으며, 그 후 XOLAIR 또는 위약에 무작위 배정되었습니다. 환자들은 급성 악화로 인해 용량을 늘려야 하는 경우를 제외하고는 코르티코스테로이드 용량을 변경하지 않고 16주 동안 XOLAIR를 투여받았습니다. 그런 다음 환자들은 12주 동안의 ICS 감량 단계에 들어갔고, 이 기간 동안 ICS 용량 감량을 단계적으로 시도했습니다.
연구 기간 동안 각 그룹의 환자당 천식 악화 횟수 분포를 안정적인 스테로이드 기간과 스테로이드 감량 기간으로 나누어 분석했습니다.
천식 시험 1과 2 모두에서 환자당 악화 횟수는 위약군에 비해 XOLAIR 치료군에서 감소했습니다(표 11).
이러한 시험에서는 기류 측정(FEV1)과 천식 증상도 평가했습니다. 치료 관련 차이의 임상적 관련성은 알려져 있지 않습니다. 안정적인 스테로이드 단계 천식 시험 1의 결과는 표 12에 나와 있습니다. 안정적인 스테로이드 단계의 천식 시험 2와 천식 시험 1과 2의 스테로이드 감량 단계의 결과는 표 12에 제시된 것과 유사했습니다.
| 안정적인 스테로이드 단계(16주) | ||||
| 천식 시험 1 | 천식 시험 2 | |||
| 환자당 악화 횟수 | XOLAIR N=268 |
위약 N=257 |
XOLAIR N=274 |
위약 N=272 |
| 0 | 85.8% | 76.7% | 87.6% | 69.9% |
| 1 | 11.9% | 16.7% | 11.3% | 25.0% |
| ≥2 | 2.2% | 6.6% | 1.1% | 5.1% |
| p-값 | 0.005 | <0.001 | ||
| 환자당 평균 악화 횟수 | 0.2 | 0.3 | 0.1 | 0.4 |
| 스테로이드 감량 단계(12주) | ||||
| 환자당 악화 횟수 | XOLAIR N=268 |
위약 N=257 |
XOLAIR N=274 |
위약 N=272 |
| 0 | 78.7% | 67.7% | 83.9% | 70.2% |
| 1 | 19.0% | 28.4% | 14.2% | 26.1% |
| ≥2 | 2.2% | 3.9% | 1.8% | 3.7% |
| p-값 | 0.004 | <0.001 | ||
| 악화 평균 횟수/환자 | 0.2 | 0.4 | 0.2 | 0.3 |
| XOLAIR N=268* |
위약 N=257* |
|||
|---|---|---|---|---|
| 평가 지표 | 평균 기준치 | 변화량 중앙값(기준치 대비 16주차) | 평균 기준치 | 변화량 중앙값(기준치 대비 16주차) |
| 천식 증상 척도: 총점 0점(최저) ~ 9점(최고), 야간 및 주간 점수 0점(증상 없음) ~ 4점(대부분 증상). | ||||
| 총 천식 증상 점수 | 4.3 | –1.5† | 4.2 | –1.1† |
| 야간 천식 점수 | 1.2 | –0.4† | 1.1 | –0.2† |
| 주간 천식 점수 | 2.3 | –0.9† | 2.3 | –0.6† |
| FEV1 % 예측값 | 68 | 3† | 68 | 0† |
천식 임상시험 3
천식 임상시험 3에서는 스크리닝 FEV1에 대한 제한이 없었으며, 천식 임상시험 1 및 2와 달리 지속성 베타2-효능제가 허용되었습니다. 환자들은 플루티카손 프로피오네이트를 1일 1000 µg 이상 투여받았으며, 일부 환자들은 경구 코르티코스테로이드도 투여받았습니다. 다른 병용 조절제를 투여받는 환자는 제외되었으며, 연구 중 추가 조절제의 시작은 금지되었습니다. 현재 흡연 중인 환자는 제외되었습니다.
이 임상시험은 공통 ICS(플루티카손 프로피오네이트)로의 안정적인 전환을 달성하기 위한 실행 기간으로 구성되었으며, 이후 XOLAIR 또는 위약으로 무작위 배정되었습니다. 환자들은 ICS 단독 사용 또는 경구 스테로이드와 ICS 병용 사용으로 계층화되었습니다. 환자들은 급성 악화로 인해 증량이 필요한 경우를 제외하고 변경되지 않은 코르티코스테로이드 용량으로 16주 동안 XOLAIR를 투여받았습니다. 그런 다음 환자들은 16주 동안의 ICS 감량 단계에 들어갔고, 이 기간 동안 ICS 또는 경구 스테로이드 용량 감량이 단계적으로 시도되었습니다.
XOLAIR로 치료받은 환자의 악화 횟수는 위약 치료받은 환자의 악화 횟수와 유사했습니다(표 13). 관찰된 치료 효과가 없는 것은 천식 임상시험 1 및 2와 비교하여 환자 집단의 차이, 연구 표본 크기 또는 기타 요인과 관련이 있을 수 있습니다.
| 안정적인 스테로이드 단계(16주) | ||||
| 흡입만 | 경구 + 흡입 | |||
| XOLAIR N=126 |
위약 N=120 |
XOLAIR N=50 |
위약 N=45 |
|
| 악화가 1회 이상 발생한 환자의 비율 | 15.9% | 15.0% | 32.0% | 22.2% |
| 차이 (95% CI) |
0.9 (–9.7, 13.7) |
9.8 (–10.5, 31.4) |
||
| 스테로이드 감량 단계(16주) | ||||
| XOLAIR N=126 |
위약 N=120 |
XOLAIR N=50 |
위약 N=45 |
|
| 악화가 1회 이상 발생한 환자의 비율 | 22.2% | 26.7% | 42.0% | 42.2% |
| 차이 (95% CI) |
–4.4 (–17.6, 7.4) |
–0.2 (–22.4, 20.1) |
||
세 가지 임상시험 모두에서 무작위 배정 당시 FEV1>80%였던 XOLAIR 치료 환자에서 천식 악화 감소가 관찰되지 않았습니다. 유지 요법으로 경구 스테로이드가 필요한 환자에서는 악화 감소가 나타나지 않았습니다.
6세 이상 12세 미만 소아 환자
중등도에서 중증의 천식이 있는 6세 이상 12세 미만 소아 환자에서 XOLAIR의 안전성 및 유효성은 무작위 배정, 이중맹검, 위약 대조, 다기관 임상시험(천식 임상시험 4[NCT00079937]) 및 추가 지원 연구(천식 임상시험 5)를 기반으로 합니다.
천식 임상시험 4는 흡입 코르티코스테로이드(플루티카손 프로피오네이트 DPI ≥200mcg/일 또는 이에 상응하는 용량)와 기타 조절제 천식 약물을 함께 사용했음에도 불구하고 적절하게 조절되지 않는 중등도에서 중증의 천식이 있는 6세 이상 12세 미만 소아 환자 628명을 대상으로 추가 요법으로서 XOLAIR의 안전성 및 유효성을 평가한 52주 연구였습니다. 연구 참여 기준을 충족하는 환자는 천식 진단을 받은 지 1년이 넘었고, 최소 1가지 이상의 연중 알레르겐에 대한 피부단자검사 양성 반응을 보였으며, 연구 참여 전 1년 이내에 주간 및/또는 야간 증상 및 악화와 같은 임상적 특징이 있었던 환자였습니다. 치료 첫 24주 동안 스테로이드 용량은 기준치에서 일정하게 유지되었습니다. 이후 28주 동안 흡입 코르티코스테로이드 조정이 허용되었습니다.
일차 유효성 변수는 24주간의 고정 스테로이드 치료 기간 동안의 천식 악화 비율이었습니다. 천식 악화는 연구자의 임상적 판단에 따라 천식 증상이 악화되어 기준치 흡입 코르티코스테로이드 용량을 최소 3일 동안 두 배로 늘리거나 구조 전신(경구 또는 IV) 코르티코스테로이드 치료를 최소 3일 동안 받아야 하는 경우로 정의되었습니다. 24주차에 XOLAIR군은 위약군에 비해 천식 악화 비율이 통계적으로 유의하게 낮았습니다(0.45 vs. 0.64, 추정 비율비 0.69, 95% CI: 0.53, 0.90).
또한 XOLAIR군은 52주 전체 이중맹검 치료 기간 동안 위약군에 비해 천식 악화 비율이 낮았습니다(0.78 vs. 1.36, 비율비: 0.57, 95% CI: 0.45, 0.72). 야간 증상 점수, 베타 작용제 사용, 기류 측정값(FEV1)과 같은 기타 유효성 변수는 XOLAIR 치료 환자와 위약군 간에 유의한 차이가 없었습니다.
천식 임상시험 5는 흡입 코르티코스테로이드(베클로메타손 디프로피오네이트 168~420mcg/일)로 잘 조절되고 있는 중등도에서 중증의 천식이 있는 6세 이상 12세 미만 소아 환자 298명을 포함한 소아 환자 334명을 대상으로 안전성을 주로 평가한 28주 무작위 배정, 이중맹검, 위약 대조 연구였습니다. 16주 스테로이드 치료 기간 후 12주 스테로이드 용량 감량 기간이 이어졌습니다. XOLAIR로 치료받은 환자는 16주 고정 스테로이드 치료 기간(0.18 vs. 0.32, 비율비: 0.58, 95% CI: 0.35, 0.96) 및 28주 치료 기간(0.38 vs. 0.76, 비율비: 0.50, 95% CI: 0.36, 0.71) 모두에서 위약군에 비해 천식 악화가 적었습니다.
14.2 비용종을 동반한 만성 부비동염
18세 이상 성인 환자
XOLAIR의 안전성 및 유효성은 비강 코르티코스테로이드에 대한 반응이 불충분한 비용종을 동반한 만성 부비동염(CRSwNP) 환자를 등록한 두 건의 무작위 배정, 다기관, 이중맹검, 위약 대조 임상시험(CRSwNP 임상시험 1[NCT03280550] 및 CRSwNP 임상시험 2[NCT03280537])에서 평가되었습니다(CRSwNP 임상시험 1, n=138, CRSwNP 임상시험 2, n=127). 환자들은 표 3에 따라 24주 동안 2주 또는 4주마다 XOLAIR 또는 위약 SC를 투여받았으며, 이후 4주간의 추적 관찰 기간을 거쳤습니다. 모든 환자는 치료 기간과 5주간의 실행 기간 동안 비강 모메타손 요법을 병행했습니다. 무작위 배정 전에 환자는 실행 기간 동안 비강 모메타손을 사용했음에도 불구하고 각 비강에서 NPS ≥ 2이고 비강 용종 점수(NPS) ≥ 5로 확인된 양측 용종의 증거가 있어야 했습니다. NPS는 내시경을 통해 측정했으며, 총 NPS(범위 0~8)에 대해 점수를 매겼습니다(비강당 범위 0~4: 0= 용종 없음, 1= 중비도에 있는 작은 용종으로 하비갑개의 하단 경계 아래로 닿지 않음, 2= 중비갑개의 하단 경계 아래로 닿는 용종, 3= 하비갑개의 하단 경계에 닿는 큰 용종 또는 중비갑개 내측의 용종, 4= 하비강을 완전히 막는 큰 용종). 또한 환자는 무작위 배정 전에 비강 모메타손을 사용했음에도 불구하고 주간 평균 비강 울혈 점수(NCS)가 > 1이어야 했습니다. 비강 울혈은 0~3점의 중증도 척도(0=없음, 1=경도, 2=중등도, 3=중증)에 따라 매일 평가하여 측정했습니다. 이전의 부비동 코 수술 또는 이전의 전신 코르티코스테로이드 사용은 임상시험에 포함하기 위한 요건이 아니었으며, 부비동 불투명화를 평가하기 위해 부비동 CT 스캔을 시행하지 않았습니다. 알레르기 동반 질환을 포함한 인구 통계 및 기준 특성은 표 14에 설명되어 있습니다.
| 매개변수 | CRSwNP 임상시험 1 (n=138) |
CRSwNP 임상시험 2 (n=127) |
|---|---|---|
| CRSwNP= 비용종을 동반한 만성 부비동염, SD=표준 편차, NPS=비강 용종 점수, IgE=면역글로불린 E, IU=국제 단위. NPS, NCS, 후각, 후비루, 콧물의 경우 점수가 높을수록 질병의 중증도가 높음을 나타냅니다. | ||
| 평균 연령(세)(SD) | 51(13) | 50(12) |
| 남성 비율(%) | 64 | 65 |
| Patients with systemic corticosteroid use in the previous year (%) | 19 | 26 |
| Patients with prior surgery for nasal polyps (%) | 79 (57) | 79 (62) |
| Mean bilateral endoscopic NPS (SD), range 0-8 | 6.2 (1.0) | 6.3 (0.9) |
| Mean nasal congestion score (SD) range 0-3 | 2.4 (0.6) | 2.3 (0.7) |
| Mean sense of smell score (SD) range 0-3 | 2.7 (0.7) | 2.7 (0.7) |
| Mean post nasal drip score (SD) range 0-3 | 1.8 (0.9) | 1.7 (0.9) |
| Mean runny nose score (SD) range 0-3 | 2.0 (0.8) | 1.9 (0.9) |
| Mean blood eosinophils (cells/mcL) (SD) | 346 (284) | 335 (188) |
| Mean total IgE IU/mL (SD) | 161 (140) | 190 (201) |
| Asthma (%) | 54 | 61 |
| Aspirin exacerbated respiratory disease (%) | 20 | 35 |
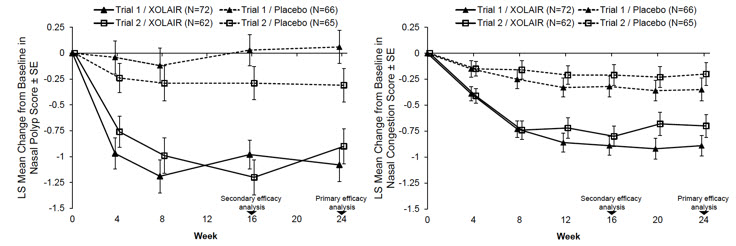
CRSwNP 임상시험 1상 및 2상의 공동 1차 평가변수는 24주차의 NPS 및 일일 평균 NCS였습니다. 두 임상시험 모두에서 XOLAIR를 투여받은 환자는 위약을 투여받은 환자보다 24주차에 NPS 및 주간 평균 NCS에서 기준치 대비 통계적으로 유의하게 더 큰 개선을 보였습니다. CRSwNP 임상시험 1상 및 2상의 결과는 표 15에 나와 있습니다.
그림 1에서 볼 수 있듯이 두 연구 모두에서 4주차에 첫 번째 평가만큼 일찍 위약군에 비해 XOLAIR군에서 NPS 및 NCS가 더 크게 개선되었습니다.
| 임상시험 1상 | 임상시험 2상 | |||
|---|---|---|---|---|
| 위약 | XOLAIR | 위약 | XOLAIR | |
| CRSwNP= 비폴립을 동반한 만성 부비동염, LS=최소 제곱. 기준치 대비 변화는 기준 점수, 기준 점수/시점(주) 상호작용을 공변량으로 하고 지리적 지역, 천식/아스피린 민감성 동반질환 상태, 시점, 치료군, 치료/시점 상호작용을 요인으로 하는 반복 측정(MMRM) 모델의 혼합 효과 모델을 사용하여 분석했습니다. | ||||
| 환자 수 | 65 | 72 | 65 | 62 |
| 비폴립 점수 | ||||
| 평균 기준 점수 | 6.3 | 6.2 | 6.1 | 6.4 |
| 24주차에 기준치 대비 LS 평균 변화 | 0.1 | -1.1 | -0.3 | -0.9 |
| 위약 대비 LS 평균 차이 | -1.1 | -0.6 | ||
| 차이에 대한 95% CI | -1.6, -0.7 | -1.1, -0.1 | ||
| p-값 | <0.0001 | 0.0140 | ||
| 일일 비폐색 점수의 7일 평균 | ||||
| 평균 기준 점수 | 2.5 | 2.4 | 2.3 | 2.3 |
| 24주차에 기준치 대비 LS 평균 변화 | -0.4 | -0.9 | -0.2 | -0.7 |
| 위약 대비 LS 평균 차이 | -0.6 | -0.5 | ||
| 차이에 대한 95% CI | -0.8, -0.3 | -0.8, -0.2 | ||
| p-값 | 0.0004 | 0.0017 | ||
각 연구 주별 치료 그룹의 평균 NPS 및 NCS는 그림 1에 나와 있습니다.
|
|
XOLAIR은 위약에 비해 후각 점수에서 통계적으로 유의미한 개선을 보였습니다. 후각은 0~3점의 중증도 척도(0=증상 없음, 1=경증, 2=중등도, 3=중증)로 매일 평가하여 측정했습니다. 24주차에 후각 점수의 기준치 대비 변화에 대한 최소 제곱 평균 차이는 CRSwNP 1상 시험에서 XOLAIR이 위약에 비해 -0.3(95% CI: -0.6, -0.1)였고 CRSwNP 2상 시험에서는 -0.5(95% CI: -0.7, -0.2)였습니다.
XOLAIR은 위약에 비해 후비루에서 통계적으로 유의미한 개선을 보였습니다. 24주차에 후비루 점수의 기준치 대비 변화에 대한 최소 제곱 평균 차이는 CRSwNP 1상 시험에서 XOLAIR이 위약에 비해 -0.6(95% CI: -0.8, -0.3)였고 CRSwNP 2상 시험에서는 -0.5(95% CI: -0.8, -0.3)였습니다.
XOLAIR은 위약에 비해 콧물에서 통계적으로 유의미한 개선을 보였습니다. 24주차에 콧물 점수의 기준치 대비 변화에 대한 최소 제곱 평균 차이는 CRSwNP 1상 시험에서 XOLAIR이 위약에 비해 -0.4(95% CI: -0.7, -0.2)였고 CRsWNP 2상 시험에서는 -0.6(95% CI: -0.9, -0.4)였습니다.
24주 치료 기간 동안의 전신 코르티코스테로이드 사용에 대한 사전 지정된 취합 분석에서 치료군 간에 전신 코르티코스테로이드 사용의 유의미한 감소는 없었습니다. XOLAIR에서 전신 코르티코스테로이드를 복용한 환자의 비율은 2.3%였고 위약은 6.2%였습니다. 위약에 비해 XOLAIR을 사용한 전신 코르티코스테로이드 사용의 오즈비는 0.4(95% CI: 0.1, 1.5)였습니다.
두 시험 모두에서 위약군 또는 XOLAIR군 모두에서 비강 수술 보고는 없었습니다.
14.3 IgE-매개 식품 알레르기
XOLAIR의 안전성과 유효성은 땅콩 및 우유, 계란, 밀, 캐슈, 헤이즐넛 또는 호두를 포함한 최소 2가지 이상의 식품(즉, 연구 식품)에 알레르기가 있는 1세 이상 56세 미만의 성인 환자와 소아 환자 168명을 대상으로 한 다기관, 무작위 배정, 이중맹검, 위약 대조 식품 알레르기(FA) 시험[NCT03881696]에서 평가되었습니다. FA 시험에는 스크리닝 이중맹검 위약 대조 식품 챌린지(DBPCFC) 동안 단일 용량의 땅콩 단백질 ≤100mg 및 다른 두 가지 식품(우유, 계란, 밀, 캐슈, 헤이즐넛 또는 호두) 각각에 대해 단백질 ≤300mg에 대해 용량 제한 증상(예: 중등도에서 중증의 피부, 호흡기 또는 위장관 증상)을 경험한 환자가 등록되었습니다. 중증 아나필락시스(신경학적 손상으로 정의되거나 기관내 삽관이 필요함) 병력이 있는 환자는 연구에서 제외되었습니다. 환자는 표 4 [용량 및 투여(2.4) 참조]에 따라 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL) 및 체중을 기준으로 16~20주 동안 XOLAIR 또는 위약의 피하 주사를 받도록 2:1로 무작위 배정되었습니다. 16~20주 치료 후 각 환자는 위약과 3가지 연구 식품 각각으로 구성된 DBPCFC를 완료했습니다. DBPCFC 이후, 연구의 이중맹검, 위약 대조 단계를 완료한 소아 환자 59명과 성인 환자 1명을 포함한 처음 60명의 환자는 24~28주 공개 표지 연장 연구에서 XOLAIR을 계속 투여받을 수 있었습니다.
XOLAIR의 유효성은 아래에 제공된 유효성 분석에 포함된 소아 환자 165명을 기반으로 합니다. 소아 환자의 평균 연령은 8세(연령 범위: 1~17세)였으며, 37%는 6세 미만, 38%는 6세 이상 12세 미만, 25%는 12세 이상 18세 미만이었습니다. 환자 집단은 남성 56%, 백인 63%, 아시아인 13%, 흑인 7%, 기타 16%였으며, 환자의 55%는 천식 병력이 있었습니다.
일차 유효성 평가 변수는 DBPCFC 동안 용량 제한 증상(예: 중등도에서 중증의 피부, 호흡기 또는 위장관 증상) 없이 땅콩 단백질 ≥600mg의 단일 용량을 섭취할 수 있는 환자의 비율이었습니다. 표 16에서 XOLAIR 치료는 위약(5%)보다 통계적으로 더 높은 반응률(68%)을 나타냈습니다.
이차 유효성 평가 변수는 DBPCFC 동안 용량 제한 증상 없이 캐슈, 우유 또는 계란 단백질 ≥1,000mg의 단일 용량을 섭취할 수 있는 환자의 비율이었습니다. 이 연구는 이차 평가 변수를 충족했으며 XOLAIR 치료가 세 가지 식품 모두에서 위약보다 통계적으로 더 높은 반응률을 나타냈습니다. 자세한 내용은 표 16을 참조하십시오.
| 식품, 챌린지 용량 | 반응률* (%) (n/N) |
치료 차이 (%) (XOLAIR-위약) (95% CI) |
|
|---|---|---|---|
| XOLAIR | 위약 | ||
| CI = 신뢰 구간, DBPCFC = 이중맹검 위약 대조 식품 챌린지, n = 반응자 수, N = 식품, 챌린지 용량을 투여받은 환자의 총 수 참고: 종료 DBPCFC가 없거나 평가 가능한 종료 DBPCFC가 없는 대상체는 비반응자로 간주되었습니다. 양측 Fisher 정확 검정의 P 값은 모든 식품 챌린지 용량에 대해 <0.0001이었습니다. |
|||
| 땅콩, ≥600mg | 68% (75/110) |
5% (3/55) |
63% (50%, 73%) |
| Peanut, ≥1000 mg† | 65% (72/110) |
0% (0/55) |
65% (56%, 74%) |
| Cashew, ≥1000 mg | 42% (27/64) |
3% (1/30) |
39% (20%, 53%) |
| Milk, ≥1000 mg | 66% (25/38) |
11% (2/19) |
55% (29%, 73%) |
| Egg, ≥1000 mg | 67% (31/46) |
0% (0/19) |
67% (49%, 80%) |
XOLAIR를 투여받은 환자의 17%는 중등도에서 중증의 용량 제한 증상 없이 100mg 초과의 땅콩 단백질을 섭취할 수 없었습니다. XOLAIR를 투여받은 환자의 18%, 22%, 41%는 중등도에서 중증의 용량 제한 증상 없이 각각 300mg 초과의 우유, 달걀, 캐슈넛 단백질을 섭취할 수 없었습니다.
추가적인 2차 분석에는 DBPCFC 동안 두 가지 이상 또는 세 가지 모든 음식을 섭취할 수 있는 환자의 비율이 포함되었습니다. 두 가지 음식의 경우, XOLAIR를 투여받은 환자의 71%가 위약군의 5%에 비해 단일 용량 ≥600mg을 섭취할 수 있었고, 67%는 위약군의 4%에 비해 단일 용량 ≥1000mg을 섭취할 수 있었습니다. 세 가지 음식의 단일 용량 ≥600mg의 경우, 반응률은 XOLAIR군이 48%인 반면 위약군은 4%였으며, 세 가지 음식의 단일 용량 ≥1000mg의 경우, XOLAIR군의 반응률은 39%였던 반면, 위약군 환자는 아무도 증상 없이 시험 용량을 섭취할 수 없었습니다.
성인에서 XOLAIR의 유효성은 소아 환자를 대상으로 한 적절하고 잘 통제된 XOLAIR 시험, 소아 환자와 성인 환자의 질병 유사성, 약동학(PK) 유사성에 의해 뒷받침됩니다 [see Clinical Pharmacology (12.3)].
비록 비대조, 공개 라벨 연구에서 유효성을 확립할 수는 없지만, 공개 라벨 연장 연구에서 24-28주 동안 XOLAIR를 계속 투여받은 38명의 소아 환자의 경우, 중등도에서 중증의 용량 제한 증상 없이 ≥600mg의 땅콩 단백질과 ≥1000mg의 달걀, 우유, 및/또는 캐슈넛 단백질을 섭취할 수 있는 환자의 비율이 유지되었습니다.
14.4 만성 특발성 두드러기
12세 이상 성인 및 청소년 환자
이전에 만성 특발성 두드러기(CIU)라고 불렸던 만성 자발성 두드러기(CSU) 치료를 위한 XOLAIR의 안전성과 유효성은 24주 동안(CSU 시험 1, n=319, [NCT01287117]) 및 12주 동안(CSU 시험 2, n=322, [NCT01292473]) 실시된 위약 대조, 다회 투여 임상시험 두 건에서 평가되었습니다. 환자들은 24주 또는 12주 동안 기준 H1 항히스타민제 요법에 추가하여 4주마다 XOLAIR 75mg, 150mg 또는 300mg 또는 위약을 SC 주사로 투여받은 후 16주간의 치료 중단 관찰 기간을 거쳤습니다. 총 640명의 환자(남성 165명, 여성 475명)가 유효성 분석에 포함되었습니다. 대부분의 환자는 백인(84%)이었고, 평균 연령은 42세(범위 12~72세)였습니다.
질병 중증도는 주간 두드러기 활성도 점수(UAS7, 범위 0~42)로 측정되었으며, 이는 주간 가려움증 중증도 점수(범위 0~21)와 주간 두드러기 개수 점수(범위 0~21)를 합성한 것입니다. 모든 환자는 무작위 배정 전 최소 2주 동안 H1 항히스타민제를 사용했음에도 불구하고 UAS7 ≥16점, 주간 가려움증 중증도 점수 ≥8점을 기록해야 했습니다.
기준 시점에서 주간 평균 가려움증 중증도 점수는 치료군 간에 상당히 균형이 잡혔으며, 승인된 용량의 H1 항히스타민제를 사용했음에도 불구하고 13.7~14.5점이었습니다. 등록 시 보고된 CSU의 평균 지속 기간은 치료군 전반에 걸쳐 2.5~3.9년(전체 대상 수준 범위 0.5~66.4년)이었습니다.
CSU 시험 1과 2에서 XOLAIR 150mg 또는 300mg을 투여받은 환자는 12주차에 위약보다 주간 가려움증 중증도 점수와 주간 두드러기 개수 점수가 기준치보다 더 크게 감소했습니다. CSU 시험 1의 대표적인 결과가 표시되어 있습니다(표 17). CSU 시험 2에서도 유사한 결과가 관찰되었습니다. 75mg 용량은 일관된 유효성 증거를 보여주지 못했으며, 사용이 승인되지 않았습니다.
| XOLAIR 75mg |
XOLAIR 150mg |
XOLAIR 300mg |
위약 | |
|---|---|---|---|---|
| N | 77 | 80 | 81 | 80 |
| 주간 가려움증 중증도 점수 | ||||
| 평균 기준 점수(SD) | 14.5(3.6) | 14.1(3.8) | 14.2(3.3) | 14.4(3.5) |
| 평균 변화 12주차(SD) | −6.46(6.14) | −6.66(6.28) | −9.40(5.73) | −3.63(5.22) |
| 위약 대비 LS 평균의 차이 | −2.96 | −2.95 | −5.80 | |
| 차이에 대한 95% CI | −4.71, −1.21 | −4.72, −1.18 | −7.49, −4.10 | – |
| 주간 두드러기 개수 점수 † | ||||
| 평균 기준 점수(SD) | 17.2(4.2) | 16.2(4.6) | 17.1(3.8) | 16.7(4.4) |
| 평균 변화 12주차 (SD) | −7.36 (7.52) | −7.78 (7.08) | −11.35 (7.25) | −4.37 (6.60) |
| 위약 대비 LS 평균의 차이 | −2.75 | −3.44 | −6.93 | |
| 차이에 대한 95% CI | −4.95, −0.54 | −5.57, −1.32 | −9.10, −4.76 | – |
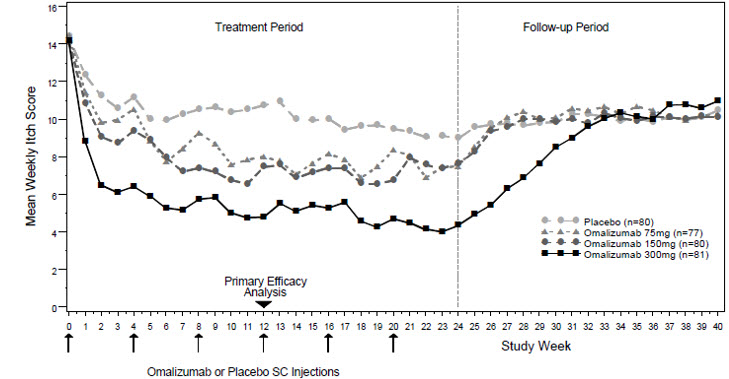
치료군별 주별 평균 가려움증 중증도 점수는 그림 2에 나와 있습니다. CSU 임상시험 1의 대표적인 결과가 나와 있습니다. CSU 임상시험 2에서도 유사한 결과가 관찰되었습니다. XOLAIR를 이용한 CSU에 대한 적절한 치료 기간은 아직 결정되지 않았습니다.
|
|
CSU 임상시험 1에서 12주차에 XOLAIR 300mg을 투여받은 환자(36%)가 XOLAIR 150mg(15%), XOLAIR 75mg(12%) 및 위약군(9%)을 투여받은 환자에 비해 가려움증과 두드러기가 없는 것으로 보고되었습니다(UAS7=0). CSU 임상시험 2에서도 유사한 결과가 관찰되었습니다.
16 제공/보관 및 취급 방법
주사제 (사전 충전 주사기 또는 자동 주사기)
XOLAIR (omalizumab) 주사제는 피하 주사용 투명 또는 약간 불투명하고 무색에서 옅은 갈색을 띤 노란색 용액입니다.
XOLAIR 주사제는 고정된 바늘, 단단한 바늘 캡 및 바늘 보호대가 있는 단일 용량 사전 충전 주사기 또는 고정된 바늘, 바늘 캡 및 바늘 가드가 있는 단일 용량 사전 충전 자동 주사기로 제공됩니다.
XOLAIR는 표 18 및 19에 설명된 바와 같이 사전 충전 주사기 및 자동 주사기로 제공됩니다.
| 포장 구성 | 강도 | NDC |
|---|---|---|
|
||
| 26 게이지 고정 바늘이 있는 사전 충전 주사기 1개* | 75 mg/0.5 mL | NDC 50242-214-01 |
| 26 게이지 고정 바늘이 있는 사전 충전 주사기 1개* | 150 mg/mL | NDC 50242-215-01 |
| 27 게이지 고정 바늘이 있는 사전 충전 주사기 1개 | 75 mg/0.5 mL | NDC 50242-214-03 |
| 27 게이지 고정 바늘이 있는 사전 충전 주사기 1개 | 150 mg/mL | NDC 50242-215-03 |
| 27 게이지 고정 바늘이 있는 사전 충전 주사기 1개 | 300 mg/2 mL | NDC 50242-227-01 |
| 포장 구성 | 강도 | NDC |
|---|---|---|
| 27 게이지 고정 바늘이 있는 자동 주사기 1개 | 75 mg/0.5 mL | NDC 50242-214-55 |
| 27 게이지 고정 바늘이 있는 자동 주사기 1개 | 150 mg/mL | NDC 50242-215-55 |
| 27 게이지 고정 바늘이 있는 자동 주사기 1개 | 300 mg/2 mL | NDC-50242-227-55 |
XOLAIR 자동 주사기는 천연 고무 라텍스로 만들어지지 않았습니다.
주사용 (바이알)
XOLAIR는 방부제가 없는 단일 용량 바이알에 백색의 동결 건조된 무균 분말로 제공됩니다. 각 상자에는 다음이 포함되어 있습니다.
- XOLAIR® (omalizumab) 150 mg 주사용 단일 용량 바이알 1개 NDC 50242-040-62.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨 (약물 안내 및 사용 지침)을 읽도록 지시하십시오.
아나필락시스
환자에게 다음 사항을 포함하여 XOLAIR와 관련된 생명을 위협하는 아나필락시스의 위험을 알리십시오 [경고 및 경고 및 주의 사항 (5.1) 참조]:
- XOLAIR 투여 후 최대 4일까지 아나필락시스가 발생했다는 보고가 있습니다.
- XOLAIR는 의료 전문가에 의해 의료 환경에서만 시작하십시오.
- 투여 후 환자를 주의 깊게 관찰하십시오.
- 환자에게 아나필락시스의 징후와 증상을 알리십시오.
- 이러한 징후나 증상이 나타나면 즉시 의료 서비스를 받도록 환자에게 지시하십시오.
아나필락시스 응급 치료와 관련된 잠재적인 약물 오류
환자, 부모 또는 보호자에게 XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에 사용해서는 안 된다는 것을 알리십시오 [경고 및 주의 사항 (5.9) 참조].
다른 약물의 지속
XOLAIR를 투여받는 환자에게 의사의 지시가 없는 한 다른 천식, CRSwNP, CSU 또는 IgE 매개 식품 알레르기 약물 또는 알레르기 면역 요법의 용량을 줄이거나 중단하지 말라고 지시하십시오. 환자에게 XOLAIR 치료를 시작한 후 천식, CRSwNP, CSU 또는 IgE 매개 식품 알레르기 증상이 즉시 개선되지 않을 수 있다는 것을 알리십시오.
사전 충전 주사기 바늘 덮개에는 라텍스가 포함되어 있습니다.
환자에게 사전 충전 주사기의 바늘 덮개에는 라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있는 건조 천연 고무(라텍스 유도체)가 포함되어 있다는 것을 알리십시오 [포장 단위/보관 및 취급 (16) 참조].
주사 기술에 대한 지침
환자 또는 보호자가 피하 XOLAIR 사전 충전 주사기 또는 자동 주사기를 투여하는 경우 주사 기술에 대한 지시를 하고 피하 주사를 할 수 있는지 평가하여 XOLAIR가 적절하게 투여되도록 하십시오. 처방된 용량을 완료하기 위해 2회 이상 주사가 필요한 환자의 경우 모든 주사를 연속적으로 한 번에 투여하도록 지시하십시오 [용량 및 투여 (2.7), 경고 및 주의 사항 (5.1) 및 사용 지침 참조].
SPL 미분류 섹션
제조사:
Genentech, Inc.
로슈 그룹 회원
1 DNA Way
South San Francisco, CA 94080-4990
미국 라이선스 번호: 1048
약물 안내문
| This Medication Guide has been approved by the U.S. Food and Drug Administration | Revised:2/2024 | |
| MEDICATION GUIDE | ||
| XOLAIR® (ZOHL-air) (omalizumab) injection, for subcutaneous use |
XOLAIR® (ZOHL-air) (omalizumab) for injection, for subcutaneous use |
|
| XOLAIR에 대해 알아야 할 가장 중요한 정보는 무엇입니까? XOLAIR는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다. 심각한 알레르기 반응. XOLAIR를 투여 받을 때 아나필락시스라고 하는 심각한 알레르기 반응이 발생할 수 있습니다. 반응은 첫 번째 투여 후 또는 여러 번 투여 후에 발생할 수 있습니다. 또한 XOLAIR 주사 직후 또는 며칠 후에 발생할 수 있습니다. 아나필락시스는 생명을 위협하는 상태이며 사망으로 이어질 수 있습니다. 알레르기 반응 증상이 나타나면 즉시 가장 가까운 응급실로 가십시오.
의료 서비스 제공자는 XOLAIR를 투여 받는 동안과 치료를 시작한 후 일정 기간 동안 알레르기 반응 증상을 주의 깊게 모니터링합니다. 알레르기 반응 증상이 나타나면 의료 서비스 제공자와 알레르기 반응 치료에 대해 상담해야 합니다. |
||
| XOLAIR는 무엇입니까? XOLAIR는 다음을 치료하는 데 사용되는 주사제로 처방된 약입니다.
XOLAIR는 아나필락시스를 포함한 모든 알레르기 반응의 응급 치료에 사용해서는 안 됩니다. XOLAIR는 다른 형태의 두드러기 또는 갑작스러운 호흡 곤란을 치료하는 데 사용해서는 안 됩니다. |
||
| 누가 XOLAIR를 투여 받고 사용해서는 안 됩니까? 다음과 같은 경우 XOLAIR를 투여 받고 사용하지 마십시오.
|
||
| XOLAIR를 투여 받기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? XOLAIR를 투여 받기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태를 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약을 의료 서비스 제공자에게 알리십시오. |
||
XOLAIR는 어떻게 투여하고 사용해야 합니까?
|
||
| XOLAIR의 가능한 부작용은 무엇입니까? XOLAIR는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
||
|
|
|
XOLAIR의 가장 흔한 부작용:
이것들은 XOLAIR의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
||
XOLAIR는 어떻게 보관해야 합니까?
XOLAIR 사전 충전 주사기 또는 자동 주입기, 날카로운 물건 처리 용기 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||
| XOLAIR의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 XOLAIR를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 XOLAIR를 주지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 XOLAIR에 대한 정보를 문의하십시오. 자세한 내용은 www.xolair.com을 방문하거나 1-866-4XOLAIR(1-866-496-5247)로 전화하십시오. |
||
| XOLAIR의 성분은 무엇입니까? 활성 성분: omalizumab 비활성 성분: 사전 충전 주사기 또는 자동 주사기: 아르기닌 히드로클로라이드, 히스티딘, L-히스티딘 히드로클로라이드 일수화물 및 폴리소르베이트 20 바이알: 히스티딘, L-히스티딘 히드로클로라이드 일수화물, 폴리소르베이트 20 및 수크로스 제조사: Genentech, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. U.S. License No.: 1048 공동 마케팅: Genentech USA, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 Novartis Pharmaceuticals Corporation, One Health Plaza, East Hanover, NJ 07936-1080 XOLAIR®는 Novartis AG의 등록 상표입니다. ©2024 Genentech USA, Inc. |
||
사용 지침
| 본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 2월 |
| 사용 설명서 Xolair® (ZOHL-air) (omalizumab) 피하 주사, 용액 사전 충전 주사기 |
|
| XOLAIR 사전 충전 주사기를 처음 사용하기 전과 재충전할 때마다 본 사용 설명서를 읽어보십시오. XOLAIR 사전 충전 주사기를 처음 사용하기 전에 의료 서비스 제공자가 올바른 사용 방법을 보여주는지 확인하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오. | |
| 하지 마십시오 XOLAIR를 아나필락시스, 두드러기 또는 갑작스러운 호흡 곤란을 포함한 알레르기 반응의 응급 치료에 사용하지 마십시오. | |
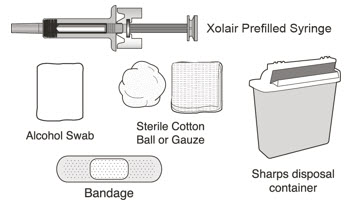
주사를 맞기 위해 필요한 물품
다음 물품은 상자에 포함되어 있지 않습니다.
|
 |
|
올바른 사전 충전 주사기 또는 사전 충전 주사기 조합 선택 |
|
|
|
|
|
|
|
XOLAIR는 어떻게 보관해야 합니까?
XOLAIR 사전 충전 주사기, 날카로운 물건 처리 용기 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
중요 정보
|
|
| 주사 준비 | |
| 1 사전 충전 주사기가 들어 있는 상자를 냉장고에서 꺼냅니다. | |
|
|
| 2 XOLAIR 상자의 유효 기간을 확인하십시오. | |
|
|
|
| 3 상자를 깨끗하고 평평한 표면에 놓습니다. | |
|
|
| 4 상자를 엽니다. | |
|
|
|
|
|
|
|
|
 |
|
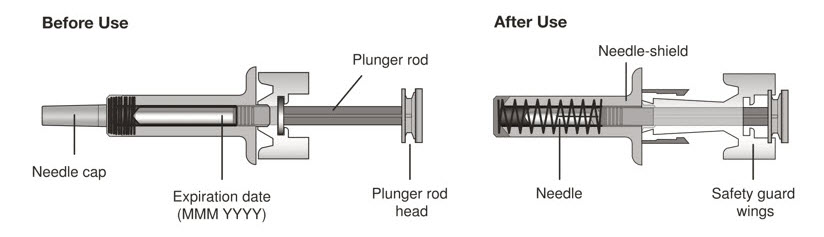
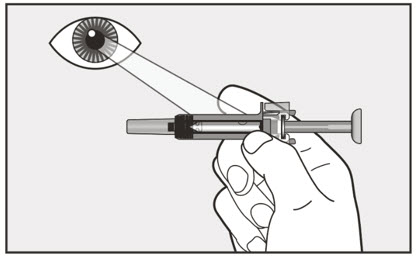
5 미리 채워진 주사기를 자세히 검사하십시오.
|
|
 |
|
| 6 주사 부위를 선택하십시오. | |
|
|
 |
|
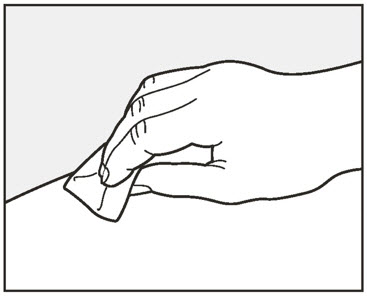
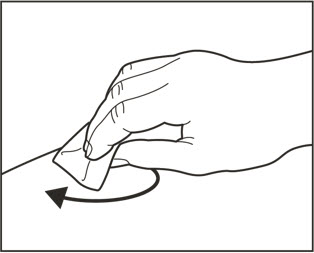
| 7 알코올 솜으로 원을 그리며 주사 부위를 닦고 10초 동안 공기 중에 말리십시오. | |
|
|
 |
|
| 주사 맞기 | |
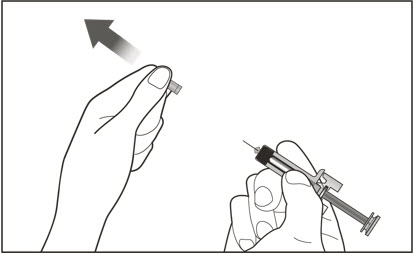
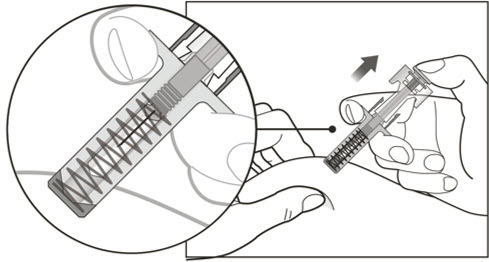
| 8 한 손으로 미리 채워진 주사기의 중앙을 단단히 잡고 다른 손으로 바늘 캡을 똑바로 잡아당깁니다. | |
|
|
|
|
|
| 9 다른 손으로 깨끗이 닦은 피부 부위를 살짝 꼬집어 잡습니다. 꼬집은 피부를 꽉 잡습니다. | |
|
|
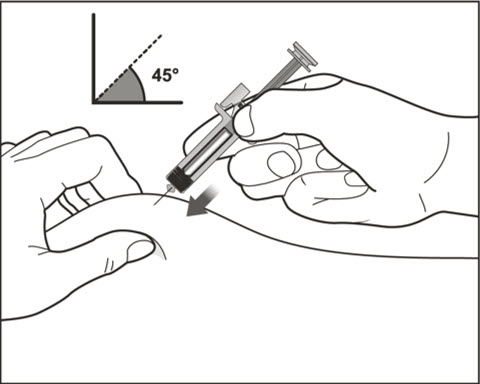
| 10 주사기 중앙을 잡고 그림과 같이 45도에서 90도 사이의 각도로 꼬집은 피부에 바늘을 완전히 삽입합니다. 바늘을 삽입할 때는 빠르고 날카로운 동작을 사용합니다. | |
 |
|
|
|
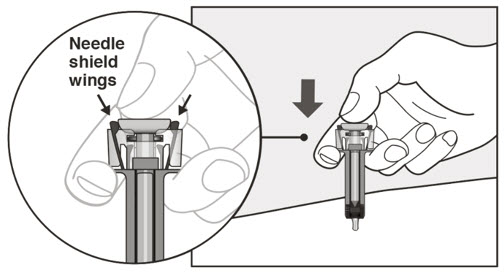
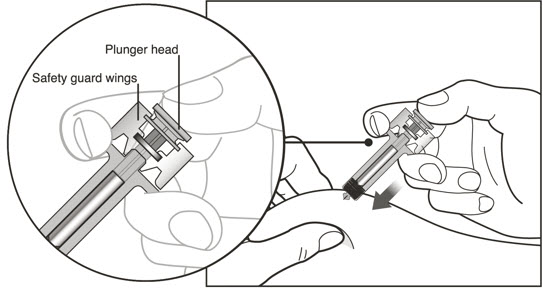
| 11 플런저를 천천히 눌러 바늘 보호대 날개가 벌어질 때까지 약물을 모두 주입합니다. | |
|
|
 |
|
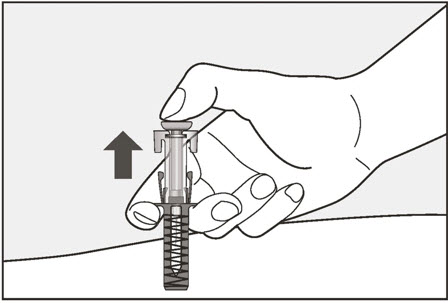
| 12 플런저를 놓고 바늘이 바늘 보호대로 덮이도록 합니다. | |
|
|
 |
|
| 13 주사 부위에 약간의 출혈이 있을 수 있습니다. 면봉이나 거즈를 주사 부위에 대고 눌러줍니다. | |
|
|
| 처방된 용량이 1회 주사 이상인 경우: | |
|
|
| 주사 후 | |
|
|
| FDA 승인 날카로운 물건 처리 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다. | |
|
|
| 제조사: Genentech, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 U.S. License No.: 1048 |
|
| 공동 마케팅: Genentech USA, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 Novartis Pharmaceuticals Corporation, One Health Plaza, East Hanover, NJ 07936-1080 |
|
| XOLAIR® is a registered trademark of Novartis AG. ©2024 Genentech USA, Inc. |
|
사용 지침
| 본 사용 지침서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 승인일: 2024년 2월 |
| 사용 지침 Xolair® (조흘-에어) (omalizumab) 피하 주사, 용액 사전 충전 주사기 |
|
| Xolair 사전 충전 주사기를 처음 사용하기 전과 재충전할 때마다 본 사용 지침을 읽어보십시오. Xolair 사전 충전 주사기를 처음 사용하기 전에 의료 서비스 제공자가 올바른 사용 방법을 보여주는지 확인하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오. | |
| 하지 마십시오 Xolair를 아나필락시스, 두드러기 또는 갑작스러운 호흡 곤란을 포함한 모든 알레르기 반응의 응급 치료에 사용하지 마십시오. | |
|
사전 충전 주사기 부품 |
|
주사를 맞기 위해 필요한 물품
다음 물품은 상자에 포함되어 있지 않습니다.
|
 |
| 참고: 처방된 용량을 맞추려면 Xolair 사전 충전 주사기가 1개 이상 필요할 수 있습니다. 자세한 내용은 용량 표를 참조하십시오. 각 Xolair 상자에는 사전 충전 주사기가 1개 들어 있습니다. | |
| 올바른 사전 충전 주사기 또는 사전 충전 주사기 조합을 선택하십시오 Xolair 사전 충전 주사기는 3가지 용량 강도로 제공됩니다(각 상자에 사전 충전 주사기 1개). 이 지침서는 3가지 용량 강도 모두에 사용됩니다. 처방된 용량을 맞추려면 1회 이상 주사가 필요할 수 있습니다. 아래의 용량 표에는 전체 용량을 맞추기 위해 필요한 사전 충전 주사기 조합이 나와 있습니다. Xolair 상자의 라벨을 확인하여 처방된 용량에 맞는 올바른 사전 충전 주사기 또는 사전 충전 주사기 조합을 받았는지 확인하십시오. 용량을 맞추기 위해 1회 이상 주사가 필요한 경우 처방된 용량에 맞는 모든 주사를 즉시 연이어 완료하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오. |
|
| 용량 표 | |
 |
|
| 참고: 의료 서비스 제공자는 전체 용량을 맞추기 위해 다른 주사기 조합을 처방할 수 있습니다. | |
Xolair는 어떻게 보관해야 합니까?
Xolair 사전 충전 주사기, 날카로운 물건 처리 용기 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
|
|
| 주사 준비 | |
| 1 사전 충전 주사기가 들어 있는 상자를 냉장고에서 꺼냅니다. | |
|
|
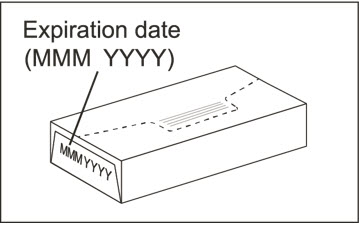
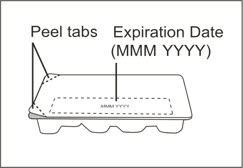
2 Xolair 상자의 유효 기간을 확인하십시오.
|
|
|
|
|
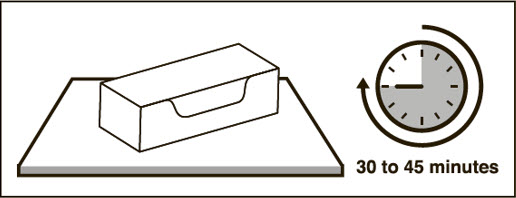
| 3 미리 채워진 주사기를 실온에 도달하도록 하십시오. | |
|
|
|
|
|
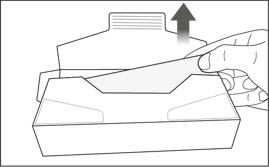
4 상자를 여십시오.
|
 |
|
 |
|
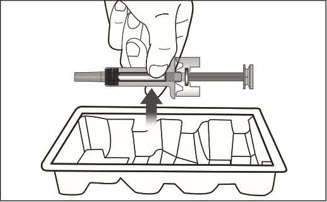 |
5 미리 채워진 주사기를 자세히 검사하십시오.
|
|
 |
|
| 6 주사할 위치를 선택하십시오. | |
|
|
 |
|
| 7 주사 부위를 깨끗이 닦으십시오. | |
|
|
 |
|
| 주사 맞기 | |
| 8 캡을 벗기십시오. | |
|
|
|
|
|
| 9 깨끗한 피부를 꼬집습니다. | |
|
|
| 10 빠르고 날카로운 동작으로 바늘을 삽입합니다. | |
|
|
 |
|
| 11 약물을 천천히 모두 주입합니다. | |
|
|
 |
|
| 12 플런저를 놓습니다. | |
|
|
 |
|
| 13 주사 부위를 관리합니다. | |
|
|
| 처방된 용량이 1회 이상의 주사를 필요로 하는 경우: | |
|
|
| 주사 후 | |
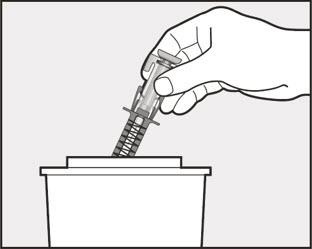
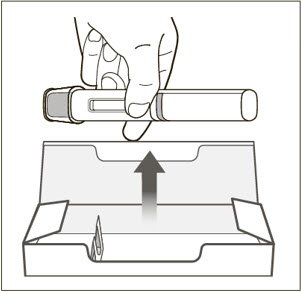
| 14 미리 채워진 주사기를 버립니다(폐기합니다). | |
|
|
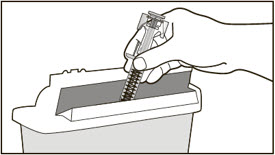 |
|
| FDA 승인 날카로운 물건 처리 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다. | |
|
|
| 제조사: Genentech, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 U.S. License No.: 1048 |
|
| 공동 마케팅: Genentech USA, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 Novartis Pharmaceuticals Corporation, One Health Plaza, East Hanover, NJ 07936-1080 |
|
| Xolair® is a registered trademark of Novartis AG. ©2024 Genentech USA, Inc. |
|
사용 지침
| This Instructions for Use has been approved by the U.S. Food and Drug Administration. | Approved: 2/2024 |
| 사용 지침 졸레어® (ZOHL-air) (오말리주맙) 주사제, 피하 사용 자동 주사기 |
|
| 졸레어 자동 주사기를 사용하기 전과 리필을 받을 때마다 이 사용 지침을 읽으십시오. 처음으로 졸레어 자동 주사기를 사용하기 전에 의료 서비스 제공자에게 올바른 사용 방법을 배우십시오. 질문이 있으면 의료 서비스 제공자에게 문의하십시오. | |
| 졸레어 자동 주사기는 만 12세 이상에게 사용합니다. | |
| 아나필락시스, 두드러기 또는 갑작스러운 호흡 곤란을 포함한 알레르기 반응의 응급 치료를 위해 졸레어를 사용하지 마십시오. | |
| 졸레어 자동 주사기 부품 | |
 |
|
주사를 놓는 데 필요한 물품
다음 물품은 상자에 포함되어 있지 않습니다.
|
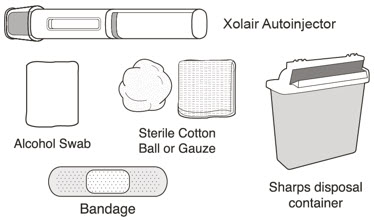 |
| 참고: 처방된 용량을 투여하려면 졸레어 자동 주사기가 1개 이상 필요할 수 있습니다. 자세한 내용은 투여량 표를 참조하십시오. 각 졸레어 상자에는 자동 주사기 1개가 들어 있습니다. | |
| 올바른 자동 주사기 또는 자동 주사기 조합 선택 | |
| 졸레어 자동 주사기는 3가지 용량 강도(각 상자에 자동 주사기 1개)로 제공됩니다. 이 지침은 3가지 용량 강도 모두에 사용됩니다. | |
| 처방된 용량에 따라 주사를 1회 이상 맞아야 할 수 있습니다. 아래 투여량 표에는 전체 용량을 투여하는 데 필요한 자동 주사기 조합이 나와 있습니다. 졸레어 상자의 라벨을 확인하여 처방된 용량에 맞는 자동 주사기 또는 자동 주사기 조합을 받았는지 확인하십시오. 용량에 따라 주사를 1회 이상 맞아야 하는 경우 처방된 용량에 따라 모든 주사를 즉시 연속으로 완료하십시오. 질문이 있으면 의료 서비스 제공자에게 문의하십시오. | |
| 투여량 표 | |
 |
|
| 참고: 의료 서비스 제공자가 전체 용량에 대해 다른 자동 주사기 조합을 처방할 수 있습니다. | |
졸레어는 어떻게 보관해야 합니까?
졸레어 자동 주사기, 날카로운 물건 처리 용기 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
중요 정보
|
|
| 주사 준비 | |
| 1 자동 주사기가 들어 있는 상자를 냉장고에서 꺼냅니다. | |
|
|
2 Xolair 상자 뒷면에 있는 유효기간을 확인하십시오.
|
|
|
|
|
| 3 오토인젝터가 실온에 도달하도록 두십시오. | |
|
|
|
|
|
| 4 상자를 엽니다. | |
|
|
|
|
|
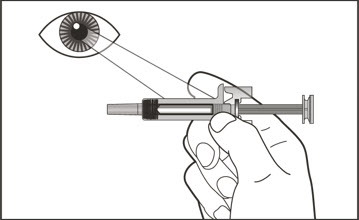
5 사용하기 전에 오토인젝터를 확인하십시오.
|
|
 |
|
| 6 주사할 위치를 선택합니다. | |
|
|
 |
|
| 7 주사 부위를 닦습니다. | |
|
|
 |
|
| 주사하기 | |
| 8 캡을 제거합니다. | |
|
|
|
|
|
| 9 오토인젝터를 놓습니다. | |
|
|
|
|
|
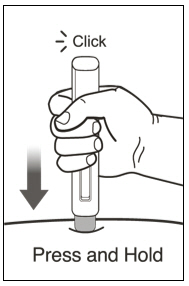
| 10 주사를 시작합니다. | |
|
|
 |
|
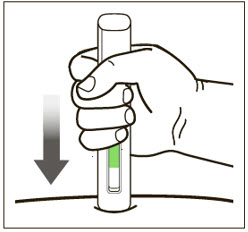
| 11 녹색 표시기를 사용하여 주사를 모니터링합니다. | |
|
|
 |
|
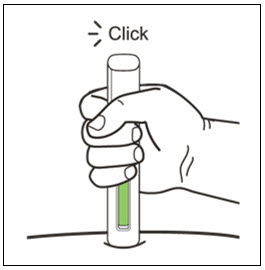
| 12 주사를 완료합니다. | |
|
|
 |
|
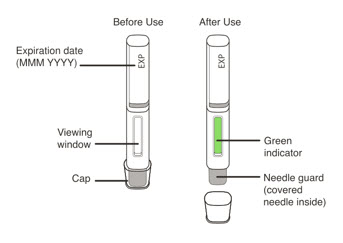
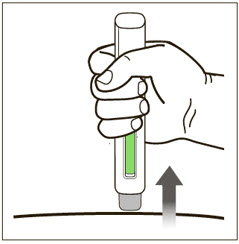
| 13 피부에서 제거하고 녹색 표시기를 확인합니다. | |
|
|
 |
|
| 14 주사 부위를 관리합니다. | |
|
|
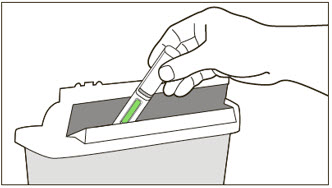
| 처방된 용량에 1회 이상 주사가 필요한 경우: | |
|
|
| 주사 후 | |
| 15 오토인젝터를 버립니다. | |
|
|
 |
|
| FDA 승인 sharps 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다. | |
|
|
| 제조: Genentech, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 U.S. License No.: 1048 |
|
| 공동 판매: Genentech USA, Inc., A Member of the Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990 Novartis Pharmaceuticals Corporation, One Health Plaza, East Hanover, NJ 07936-1080 |
|
| Xolair®는 Novartis AG의 등록 상표입니다. ©2024 Genentech USA, Inc. |
|
SPL 미분류 섹션
라벨링의 대표적인 예시 (전체 목록은 포장 단위 섹션 참조):
주요 표시 패널 – 150mg 바이알 상자
NDC 50242-040-62
SINGLE-DOSE VIAL
150 mg
Xolair®
Omalizumab
FOR SUBCUTANEOUS USE
냉장 보관. 동결하지 마십시오.
Genentech
NOVARTIS
10198215

주요 표시 패널 – 75mg/0.5mL 주사기 상자 – 214-01
Xolair®
(omalizumab) 주사제
75 mg/0.5 mL
피하 주사용. 1회 투여용 프리필드 주사기.
각 환자에게 동봉된
복약 안내서를 제공하십시오.
프리필드 주사기 1개
응급 치료에 사용하지 마십시오.
투여량에 따라 주사를 1회 이상 맞아야 할 수 있습니다.
궁금한 사항은 담당 의료 전문가에게 문의하십시오.
NDC 50242-214-01
주의: 바늘 캡에는 천연 고무 라텍스가 포함되어 있을 수 있으며,
라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있습니다.
Rx only
Genentech
NOVARTIS
11011555

주요 표시 패널 – 75 mg/0.5 mL 주사기 상자 – 214-03
Xolair®
(omalizumab) 주사제
75 mg/0.5 mL
피하 주사용.
1회용 미리 채워진 주사기
응급 치료에는 사용하지 마십시오.
투여량에 따라 1회 이상 주사가 필요할 수 있습니다.
문의 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-214-03
동봉된 약물 안내서를 각 환자에게 제공하십시오.
처방전에 의해서만 구입 가능
냉장 보관
Genentech
NOVARTIS
11011485

주요 표시 패널 – 75mg/0.5mL 자동 주사기 상자
Xolair®
(omalizumab) Injection
75 mg/0.5 mL
피하 주사용.
1회용 자동 주사기
응급 치료에는 사용하지 마십시오.
투여량에 따라 1회 이상 주사가 필요할 수 있습니다.
궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-214-55
각 환자에게 동봉된 약물 안내서를 제공하십시오.
Genentech
NOVARTIS
11011505

주요 표시 패널 – 150 mg/mL 주사기 상자 – 215-01
Xolair®
(omalizumab) 주사제
150 mg/mL
피하 주사용. 1회용 미리 채워진 주사기.
동봉된
약물 안내서를 각 환자에게 제공하십시오.
미리 채워진 주사기 1개
응급 치료에는 사용하지 마십시오.
투여량은 1회 이상의 주사가 필요할 수 있습니다.
문의 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-215-01
주의: 바늘 캡에는 천연 고무 라텍스가 포함되어 있을 수 있으며
라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있습니다.
처방전에 의해서만 사용 가능
Genentech
NOVARTIS
11011498

주요 표시 패널 – 150 mg/mL 주사기 상자 – 215-03
Xolair®
(omalizumab) Injection
150 mg/mL
피하 주사용.
1회용 미리 채워진 주사기
응급 치료에는 사용하지 마십시오.
용량에 따라 1회 이상 주사해야 할 수 있습니다.
궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-215-03
각 환자에게 동봉된 약물 안내서를 제공하십시오.
처방전에 의해서만 구입 가능
냉장 보관
Genentech
NOVARTIS
11011522

주요 표시 패널 – 150mg/mL 자동 주사기 상자
Xolair®
(omalizumab) 주사제
150 mg/mL
피하 주사용.
1회용 자동 주사기
응급 치료에는 사용하지 마십시오.
투여량에 따라 1회 이상 주사가 필요할 수 있습니다.
문의 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-215-55
동봉된 약물 안내서를 각 환자에게 제공하십시오.
Genentech
NOVARTIS
11011532

주요 표시면 – 300mg/2mL 주사기 상자
Xolair®
(omalizumab) Injection
300 mg/2 mL
피하 주사용.
1회용 미리 채워진 주사기
응급 치료에는 사용하지 마십시오.
용량에 따라 1회 이상 주사해야 할 수 있습니다.
문의 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-227-01
각 환자에게 동봉된 약물 안내서를 제공하십시오.
처방전에 의해서만 구입 가능
냉장 보관
Genentech
NOVARTIS
11011496

주요 표시면 – 300mg/2mL 자동 주사기 카톤
Xolair®
(omalizumab) 주사제
300 mg/2 mL
피하 주사용.
1회용 자동 주사기
응급 치료에는 사용하지 마십시오.
용량에 따라 1회 이상 주사가 필요할 수 있습니다.
문의 사항은 의료 서비스 제공자에게 문의하십시오.
NDC 50242-227-55
각 환자에게 동봉된 약물 안내서를 제공하십시오.
Genentech
NOVARTIS
11011548