의약품 제조업체: Janssen Biotech, Inc. (Updated: 2024-11-26)
처방 정보 하이라이트
STELARA® (우스테키누맙) 주사제, 피하 또는 정맥내 사용
미국 최초 승인: 2009년
적응증 및 용법
용법 및 용량
건선 성인 피하 투여 권장 용량 (
2.1)
:
| 체중 범위 (킬로그램) | 용량 |
|---|---|
| 100kg 이하 | 45mg을 피하 투여하여 시작하고 4주 후에 다시 45mg을 피하 투여한 후, 12주마다 45mg을 피하 투여 |
| 100kg 초과 | 90mg을 피하 투여하여 시작하고 4주 후에 다시 90mg을 피하 투여한 후, 12주마다 90mg을 피하 투여 |
건선 소아 환자 (6~17세) 피하 투여 권장 용량 (
2.1)
:
초기 용량, 4주 후, 그 후 12주마다 체중 기반 용량을 권장합니다.
| 체중 범위 (킬로그램) | 용량 |
|---|---|
| 60kg 미만 | 0.75 mg/kg |
| 60kg~100kg | 45mg |
| 100kg 초과 | 90mg |
건선성 관절염 성인 피하 투여 권장 용량 (
2.2):
- 권장 용량은 45mg을 피하 투여하여 시작하고 4주 후에 다시 45mg을 피하 투여한 후, 12주마다 45mg을 피하 투여하는 것입니다.
- 동반된 중등도에서 중증의 판상 건선이 있는 100kg 초과 환자의 경우, 권장 용량은 90mg을 피하 투여하여 시작하고 4주 후에 다시 90mg을 피하 투여한 후, 12주마다 90mg을 피하 투여하는 것입니다.
건선성 관절염 소아 (6~17세) 피하 투여 권장 용량 (
2.2):
초기 용량, 4주 후, 그 후 12주마다 체중 기반 용량을 권장합니다.
| 체중 범위 (킬로그램) | 용량 |
|---|---|
| 60kg 미만 | 0.75 mg/kg |
| 60kg 이상 | 45mg |
| 동반된 중등도에서 중증의 판상 건선이 있는 100kg 초과 | 90mg |
크론병 및 궤양성 대장염 성인 초기 정맥내 투여 권장 용량 (
2.3)
:
체중 기반 용량을 사용한 단일 정맥내 주입:
| 체중 범위 (킬로그램) | 권장 용량 |
|---|---|
| 55kg 이하 | 260mg (바이알 2개) |
| 55kg 초과 ~ 85kg | 390mg (바이알 3개) |
| 85kg 초과 | 520mg (바이알 4개) |
크론병 및 궤양성 대장염 유지 요법 성인 피하 투여 권장 용량 (
2.3)
:
초기 정맥 투여 후 8주 후 피하 90mg을 투여하고, 그 후 8주마다 투여합니다.
제형 및 함량
금기
우스테키누맙 또는 STELARA®의 어떤 첨가제에 대한 임상적으로 유의미한 과민증 (
4)
경고 및 주의사항
-
감염: 심각한 감염이 발생했습니다. 임상적으로 중요한 활성 감염 중에는 STELARA® 투여를 시작하지 마십시오. 심각한 감염 또는 임상적으로 유의미한 감염이 발생하면 감염이 해결될 때까지 STELARA® 투여를 중단하십시오. (
5.1)
-
특정 감염에 대한 이론적 위험: IL-12/IL-23 유전적으로 결핍된 환자에서 마이코박테리아, 살모넬라 및 BCG(Bacillus Calmette-Guerin) 백신 접종으로 인한 심각한 감염이 보고되었습니다. 임상 상황에 따라 이러한 감염에 대한 진단 검사를 고려하십시오. (
5.2)
-
결핵(TB): STELARA® 치료를 시작하기 전에 환자의 결핵 여부를 평가하십시오. STELARA® 투여 전에 잠복 결핵 치료를 시작하십시오. (
5.3)
-
악성종양: STELARA®는 악성종양의 위험을 증가시킬 수 있습니다. 과거력 또는 알려진 악성종양이 있는 환자에서 STELARA®의 안전성은 평가되지 않았습니다. (
5.4)
-
과민반응: 아나필락시스 또는 기타 임상적으로 유의미한 과민반응이 발생하면 적절한 치료를 하고 STELARA® 투여를 중단하십시오. (
5.5)
-
후방 가역성 뇌병증 증후군(PRES): PRES가 의심되면 즉시 치료하고 STELARA® 투여를 중단하십시오. (
5.6)
-
예방접종: STELARA® 치료 중인 환자에게는 생백신 사용을 피하십시오. (
5.7)
-
비감염성 폐렴: STELARA®의 시판 후 사용 중 간질성 폐렴, 호산구성 폐렴 및 암호성 기관지폐렴이 보고되었습니다. 진단이 확인되면 STELARA® 투여를 중단하고 적절한 치료를 시작하십시오. (
5.8)
유해반응
가장 흔한 유해반응은 다음과 같습니다.
-
건선 (≥3%):비인두염, 상기도 감염, 두통 및 피로. (
6.1)
-
크론병, 유도 (≥3%):구토. (
6.1)
-
크론병, 유지 (≥3%):비인두염, 주사 부위 홍반, 질칸디다증/진균 감염, 기관지염, 가려움증, 요로 감염 및 부비동염. (
6.1)
-
궤양성 대장염, 유도 (≥3%):비인두염 (
6.1)
-
궤양성 대장염, 유지 (≥3%):비인두염, 두통, 복통, 인플루엔자, 발열, 설사, 부비동염, 피로 및 메스꺼움 (
6.1)
의심되는 유해반응을 보고하려면 Janssen Biotech, Inc.에 1-800-JANSSEN (1-800-526-7736) 또는 FDA에 1-800-FDA-1088 또는
www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 약물 안내서에 대해서는 17번을 참조하십시오.
개정: 2024년 11월
목차
전문 정보: 목차*
1 적응증 및 용법
1.1 판상 건선 (PsO)
1.2 건선성 관절염 (PsA)
1.3 크론병 (CD)
1.4 궤양성 대장염
2 용법 및 용량
2.1 판상 건선 권장 용량
2.2 건선성 관절염 권장 용량
2.3 크론병 및 궤양성 대장염 권장 용량
2.4 투여에 대한 일반적 고려 사항
2.5 STELARA
®니들 안전 가드가 장착된 프리필드 시린지 투여 지침
2.6 STELARA
®130 mg/26 mL (5 mg/mL) 정맥 주입용 바이알 (크론병 및 궤양성 대장염) 준비 및 투여
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 감염
5.2 특정 감염에 대한 취약성의 이론적 위험
5.3 결핵 사전 평가
5.4 악성 종양
5.5 과민 반응
5.6 후방 가역성 뇌병증 증후군 (PRES)
5.7 예방 접종
5.8 비감염성 폐렴
6 이상 반응
6.1 임상 시험 경험
6.2 면역원성
6.3 시판 후 경험
7 약물 상호 작용
7.1 병용 요법
7.2 CYP450 기질
7.3 알레르겐 면역 요법
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 일반적 특성
12 약동학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능 저해
13.2 동물 약리학 및/또는 독성학
14 임상 연구
14.1 성인 판상 건선
14.2 소아 판상 건선
14.3 건선성 관절염
14.4 크론병
14.5 궤양성 대장염
15 참고 문헌
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분 또는 소분류는 나열되지 않습니다.
1 적응증 및 사용법
2 용법 및 투여
2.1 판상 건선 권장 용량
피하 성인 투여 요법
- 체중이 100kg 이하인 환자의 경우 권장 용량은 처음에 45mg을 투여하고 4주 후에 45mg을 투여한 후 12주마다 45mg을 투여하는 것입니다.
- 체중이 100kg이 넘는 환자의 경우 권장 용량은 처음에 90mg을 투여하고 4주 후에 90mg을 투여한 후 12주마다 90mg을 투여하는 것입니다.
체중이 100kg이 넘는 대상자의 경우 45mg도 효과적인 것으로 나타났습니다. 그러나 이러한 대상자에게는 90mg이 더 큰 효과를 나타냈습니다.
[참조
.
피하 소아 투여 요법
STELARA
®를 0주차와 4주차에 피하 주사로 투여하고 그 이후에는 12주마다 투여합니다.
체중에 따른 판상 건선 소아 환자(6~17세)의 STELARA
®권장 용량은 아래 표 1에 나와 있습니다.
| 투여 시 환자 체중 | 권장 용량 |
|---|---|
| 60kg 미만 | 0.75 mg/kg |
| 60kg~100kg | 45mg |
| 100kg 초과 | 90mg |
60kg 미만의 소아 환자의 경우, 권장 용량(0.75 mg/kg)에 대한 투여량은 표 2에 나와 있습니다. 1회용 바이알에서 적절한 용량을 뽑아 사용하십시오.
| 투여 시 체중 (kg) | 용량 (mg) | 주사 용량 (mL) |
|---|---|---|
|
||
| 15 | 11.3 | 0.12 |
| 16 | 12.0 | 0.13 |
| 17 | 12.8 | 0.14 |
| 18 | 13.5 | 0.15 |
| 19 | 14.3 | 0.16 |
| 20 | 15.0 | 0.17 |
| 21 | 15.8 | 0.17 |
| 22 | 16.5 | 0.18 |
| 23 | 17.3 | 0.19 |
| 24 | 18.0 | 0.20 |
| 25 | 18.8 | 0.21 |
| 26 | 19.5 | 0.22 |
| 27 | 20.3 | 0.22 |
| 28 | 21.0 | 0.23 |
| 29 | 21.8 | 0.24 |
| 30 | 22.5 | 0.25 |
| 31 | 23.3 | 0.26 |
| 32 | 24 | 0.27 |
| 33 | 24.8 | 0.27 |
| 34 | 25.5 | 0.28 |
| 35 | 26.3 | 0.29 |
| 36 | 27 | 0.3 |
| 37 | 27.8 | 0.31 |
| 38 | 28.5 | 0.32 |
| 39 | 29.3 | 0.32 |
| 40 | 30 | 0.33 |
| 41 | 30.8 | 0.34 |
| 42 | 31.5 | 0.35 |
| 43 | 32.3 | 0.36 |
| 44 | 33 | 0.37 |
| 45 | 33.8 | 0.37 |
| 46 | 34.5 | 0.38 |
| 47 | 35.3 | 0.39 |
| 48 | 36 | 0.4 |
| 49 | 36.8 | 0.41 |
| 50 | 37.5 | 0.42 |
| 51 | 38.3 | 0.42 |
| 52 | 39 | 0.43 |
| 53 | 39.8 | 0.44 |
| 54 | 40.5 | 0.45 |
| 55 | 41.3 | 0.46 |
| 56 | 42 | 0.46 |
| 57 | 42.8 | 0.47 |
| 58 | 43.5 | 0.48 |
| 59 | 44.3 | 0.49 |
2.2 건선성 관절염 권장 용량
피하 성인 투여 요법
- 권장 용량은 처음에 45mg을 투여하고 4주 후에 45mg을 투여한 후, 12주마다 45mg을 투여하는 것입니다.
- 체중이 100kg을 초과하는 중등도~중증의 판상 건선이 동반된 환자의 경우, 권장 용량은 처음에 90mg을 투여하고 4주 후에 90mg을 투여한 후, 12주마다 90mg을 투여하는 것입니다.
2.3 크론병 및 궤양성 대장염 권장 용량
2.4 투여에 대한 일반적 고려 사항
- STELARA
®는 의료 서비스 제공자의 지시 및 감독하에 사용하도록 되어 있습니다. STELARA
®는 면밀히 모니터링되고 의료 서비스 제공자와 정기적인 추적 관찰 방문을 하는 환자에게만 투여해야 합니다. 적절한 용량은 의료 서비스 제공자가 투여 시점의 환자 체중을 사용하여 결정해야 합니다. 소아 환자의 경우 의료 서비스 제공자가 STELARA
®를 투여하는 것이 좋습니다. 의료 서비스 제공자가 적절하다고 판단하는 경우, 환자는 피하 주사 기술에 대한 적절한 교육을 받은 후 스스로 주사하거나 보호자가 STELARA
®를 주사할 수 있습니다. 환자에게 약물 안내서에 제공된 지침을 따르도록 지시하십시오
[참조
.
- 프리필드 시린지의 바늘 덮개에는 건조한 천연 고무(라텍스 유도체)가 포함되어 있습니다. 라텍스에 민감한 사람은 바늘 덮개를 만지지 않아야 합니다.
- 각 주사는 이전 주사와 다른 해부학적 위치(예: 상완, 둔부, 허벅지 또는 복부의 임의 사분면)에 투여하는 것이 좋으며, 피부가 압통, 멍, 홍반 또는 경화된 부위에는 투여하지 않아야 합니다. 1회용 바이알을 사용하는 경우, 27 게이지, ½인치 바늘이 있는 1mL 주사기를 사용하는 것이 좋습니다.
- 투여 전에 이물질과 변색 여부를 시각적으로 검사하십시오. STELARA
®는 무색에서 연한 황색 용액이며, 소량의 작은 반투명 또는 흰색 입자가 포함될 수 있습니다. 변색되거나 탁하거나 다른 이물질이 있는 경우 STELARA
®를 사용하지 마십시오. STELARA
®에는 방부제가 포함되어 있지 않으므로, 바이알 및/또는 주사기에 남아 있는 사용하지 않은 제품은 버리십시오.
2.5 STELARA
®니들 세이프티 가드가 장착된 프리필드 시린지 투여 지침
제공된 지침에 대한 아래 다이어그램을 참조하십시오.
니들 세이프티 가드의 조기 작동을 방지하려면 사용 중 언제든지 NEEDLE GUARD ACTIVATION CLIPS를 만지지 마십시오.
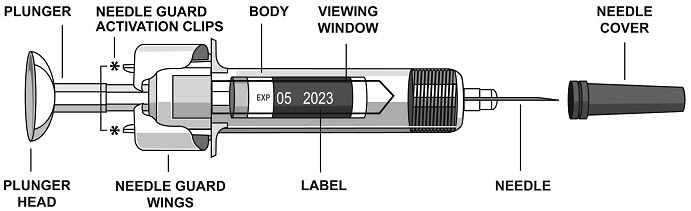
- BODY를 잡고 NEEDLE COVER를 제거합니다.
NEEDLE COVER를 제거하는 동안 PLUNGER 또는 PLUNGER HEAD를 잡지 마십시오. 그렇지 않으면 PLUNGER가 움직일 수 있습니다. NEEDLE COVER가 제자리에 없는 상태에서 프리필드 시린지가 떨어진 경우에는 사용하지 마십시오.
- 권장대로 피하에 STELARA
®를 주사합니다.
[참조
2.2,
2.3)]
.
- PLUNGER HEAD가 니들 가드 날개 사이에 완전히 들어갈 때까지 PLUNGER를 밀어 약물을 모두 주사합니다.
니들 가드를 작동하려면 프리필드 시린지 내용물 전체를 주사해야 합니다.
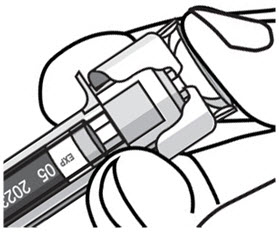
- 주사 후 PLUNGER HEAD에 압력을 유지하고 피부에서 바늘을 제거합니다. 아래 그림과 같이 니들 가드로 니들이 완전히 덮일 때까지 빈 시린지가 위로 움직이도록 PLUNGER HEAD에서 천천히 엄지를 뗍니다.
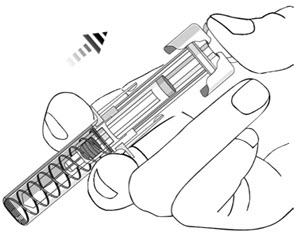
- 사용한 주사기는 펑크 방지 용기에 버려야 합니다.
2.6 STELARA
®정맥 주입용 130mg/26mL (5mg/mL) 바이알 (크론병 및 궤양성 대장염) 준비 및 투여
정맥 주입용 STELARA
®용액은 무균 기법을 사용하여 의료 전문가가 희석, 준비 및 주입해야 합니다.
- 환자 체중에 따라 STELARA®의 용량과 필요한 바이알 수를 계산합니다(표 4). STELARA® 26mL 바이알 하나에는 ustekinumab 130mg이 포함되어 있습니다.
- 250mL 주입 백에서 첨가할 STELARA® 용량과 같은 양의 0.9% 염화나트륨 주사액 USP를 제거한 후 버립니다(STELARA® 바이알 하나당 26mL의 염화나트륨을 버립니다. 바이알 2개 – 52mL 버림, 바이알 3개 – 78mL 버림, 바이알 4개 – 104mL 버림). 또는 0.45% 염화나트륨 주사액 USP가 들어있는 250mL 주입 백을 사용할 수 있습니다.
- 필요한 각 바이알에서 STELARA® 26mL를 뽑아 250mL 주입 백에 넣습니다. 주입 백의 최종 용량은 250mL여야 합니다. 부드럽게 섞습니다.
- 주입 전에 희석된 용액을 눈으로 확인합니다. 눈에 보이는 불투명한 입자, 변색 또는 이물질이 관찰되는 경우 사용하지 마십시오.
- 희석된 용액을 최소 1시간 동안 주입합니다. 희석 후 주입 백에 희석된 후 8시간 이내에 완전히 투여해야 합니다.
- 인라인, 무균, 비발열성, 저단백 결합 필터(공극 크기 0.2 마이크로미터)가 있는 주입 세트만 사용하십시오.
- 다른 약물과 동시에 같은 정맥 주사 라인으로 STELARA®를 주입하지 마십시오.
- STELARA®에는 방부제가 포함되어 있지 않습니다. 각 바이알은 1회 용량으로만 사용됩니다. 남은 용액은 버립니다. 사용하지 않은 의약품은 현지 규정에 따라 폐기하십시오.
3 제형 및 함량
STELARA
®(ustekinumab)는 무색에서 연한 황색의 용액이며, 소량의 작고 반투명하거나 흰색의 입자가 포함될 수 있습니다.
4 금기 사항
STELARA
®는 ustekinumab 또는 STELARA
®의 구성성분에 대해 임상적으로 유의미한 과민증이 있는 환자에게는 금기입니다
[경고 및 주의사항 (5.5)절 참조].
5 경고 및 주의사항
5.1 감염
STELARA®는 감염 위험 및 잠복 감염의 재활성화 위험을 증가시킬 수 있습니다. STELARA®를 투여받은 환자에서 심각한 세균성, 마이코박테리아성, 진균성 및 바이러스성 감염이 관찰되었습니다[유해 반응 (6.1), 6.3) 참조].
임상 시험에서 보고된 입원을 요하는 심각한 감염 또는 임상적으로 유의한 감염에는 다음이 포함됩니다.
- 판상 건선: 게실염, 봉와직염, 폐렴, 충수염, 담낭염, 패혈증, 골수염, 바이러스 감염, 위장염 및 요로 감염.
- 건선성 관절염: 담낭염.
- 크론병: 항문 농양, 위장염, 안구대상포진, 폐렴 및 리스테리아 수막염.
- 궤양성 대장염: 위장염, 안구대상포진, 폐렴 및 리스테리아증.
임상적으로 중요한 활성 감염이 있는 환자의 경우 감염이 해결되거나 적절하게 치료될 때까지 STELARA® 치료를 시작하지 마십시오. 만성 감염 또는 재발성 감염의 병력이 있는 환자에서 STELARA® 사용을 시작하기 전에 치료의 위험과 이점을 고려하십시오.
STELARA® 치료 중에 감염을 시사하는 징후 또는 증상이 나타나면 의학적 조언을 구하고 감염이 해결되거나 적절하게 치료될 때까지 심각하거나 임상적으로 유의한 감염에 대해 STELARA®를 중단하도록 환자에게 지시하십시오.
5.2 특정 감염에 대한 취약성의 이론적 위험
유전적으로 IL-12/IL-23이 결핍된 개인은 마이코박테리아(비결핵성 환경 마이코박테리아 포함), 살모넬라(비티푸스균 균주 포함) 및 결핵 예방 백신(BCG) 접종으로 인한 전신 감염에 특히 취약합니다. 이러한 환자에서 심각한 감염 및 치명적인 결과가 보고되었습니다.
STELARA® 치료로 인한 IL-12/IL-23의 약리학적 차단이 있는 환자가 이러한 유형의 감염에 취약해질 수 있는지 여부는 알려져 있지 않습니다. 적절한 진단 검사(예: 조직 배양, 대변 배양, 임상 상황에 따라 결정됨)를 고려하십시오.
5.3 결핵 전 치료 평가
STELARA® 치료를 시작하기 전에 환자의 결핵 감염 여부를 평가하십시오.
활성 결핵 감염이 있는 환자에게 STELARA®를 투여하지 마십시오. STELARA®를 투여하기 전에 잠복 결핵을 치료하십시오. 적절한 치료 과정을 확인할 수 없는 과거 잠복 또는 활성 결핵 병력이 있는 환자의 경우 STELARA® 시작 전에 항결핵 치료를 고려하십시오. STELARA®를 투여받는 환자의 경우 치료 중 및 치료 후 활성 결핵의 징후와 증상을 면밀히 모니터링하십시오.
5.4 악성 종양
STELARA®는 면역억제제이며 악성 종양의 위험을 증가시킬 수 있습니다. 임상 시험에서 STELARA®를 투여받은 피험자에서 악성 종양이 보고되었습니다[유해 반응 (6.1) 참조]. 설치류 모델에서 IL-12/IL-23p40의 억제는 악성 종양의 위험을 증가시켰습니다[비임상 독성학 (13) 참조].
악성 종양 병력이 있거나 알려진 악성 종양이 있는 환자에서 STELARA®의 안전성은 평가되지 않았습니다.
비흑색종 피부암 발생 위험 요인이 있는 STELARA®를 투여받는 환자에서 다발성 피부 편평세포암종이 빠르게 나타났다는 시판 후 보고가 있습니다. STELARA®를 투여받는 모든 환자의 비흑색종 피부암 발생 여부를 모니터링하십시오. 60세 이상의 환자, 장기간 면역억제제 치료 병력이 있는 환자 및 PUVA 치료 병력이 있는 환자를 면밀히 관찰하십시오[유해 반응 (6.1) 참조].
5.5 과민 반응
아나필락시스 및 안젤오에데마를 포함한 과민 반응이 STELARA®와 관련하여 보고되었습니다[유해 반응 (6.1), 6.3) 참조]. 아나필락시스 또는 기타 임상적으로 유의한 과민 반응이 발생하면 적절한 치료를 하고 STELARA®를 중단하십시오.
5.6 후방 가역성 뇌병증 증후군(PRES)
임상 시험에서 후방 가역성 뇌병증 증후군(PRES), 가역성 후방 백질뇌병증 증후군(RPLS)이라고도 하는 두 가지 사례가 보고되었습니다. 건선, 건선성 관절염 및 크론병 환자에서 시판 후 경험에서도 사례가 보고되었습니다. 임상 증상에는 두통, 발작, 혼란, 시각 장애 및 ustekinumab 투여 후 며칠에서 몇 달 후에 PRES와 일치하는 영상 변화가 포함되었습니다. 몇몇 사례에서는 1년 이상의 잠복기를 보고했습니다. 환자는 ustekinumab을 중단한 후 지지 요법으로 회복되었습니다.
STELARA®로 치료받는 모든 환자의 PRES 징후 및 증상을 모니터링하십시오. PRES가 의심되는 경우 즉시 적절한 치료를 하고 STELARA®를 중단하십시오.
5.7 예방접종
STELARA® 치료를 시작하기 전에 환자는 현재 예방 접종 지침에 따라 모든 연령에 적합한 예방 접종을 받아야 합니다. STELARA®로 치료받는 환자는 생백신을 접종해서는 안 됩니다. STELARA® 치료 중이거나 치료 시작 1년 전 또는 치료 중단 후 1년 동안 BCG 백신을 투여하지 마십시오. STELARA®를 투여받는 환자의 가족 구성원에게 생백신을 투여할 때는 가족 구성원으로부터의 탈락 및 환자에게 전염될 위험이 있으므로 주의해야 합니다.
STELARA® 치료 과정 중에 접종받은 비생백신은 질병을 예방하기에 충분한 면역 반응을 유발하지 못할 수 있습니다.
5.8 비감염성 폐렴
시판 후 STELARA® 사용 중 간질성 폐렴, 호산구성 폐렴 및 암호성 기관지폐렴 사례가 보고되었습니다. 임상 증상에는 1~3회 투여 후 기침, 호흡 곤란 및 간질성 침윤이 포함되었습니다. 심각한 결과에는 호흡 부전과 장기 입원이 포함되었습니다. 환자들은 치료 중단과 특정 경우 코르티코스테로이드 투여로 호전되었습니다. 진단이 확인되면 STELARA®를 중단하고 적절한 치료를 시작하십시오 [시판 후 경험 (6.3) 참조].
6 부작용 반응
다음과 같은 심각한 이상 반응은 라벨의 다른 부분에서 설명하고 있습니다.
- 감염
[경고 및 주의사항 (5.1) 참조
- 악성 종양
[경고 및 주의사항 (5.4) 참조
- 과민반응
[경고 및 주의사항 (5.5) 참조
- 후방 가역성 뇌병증 증후군 (PRES)
[경고 및 주의사항 (5.6) 참조
- 비감염성 폐렴
[경고 및 주의사항 (5.8) 참조
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
판상 건선 성인 대상자
안전성 데이터는 판상 건선 성인 대상자 3117명에 대한 STELARA
®노출을 반영하며, 여기에는 6개월 이상 노출된 2414명, 1년 이상 노출된 1855명, 2년 이상 노출된 1653명, 3년 이상 노출된 1569명, 4년 이상 노출된 1482명, 5년 이상 노출된 838명이 포함됩니다.
표 5는 Ps STUDY 1 및 Ps STUDY 2의 위약 대조 기간 동안 STELARA
®군에서 발생률이 1% 이상이고 발생률이 더 높았던 이상 반응을 요약한 것입니다.
[임상 연구 (14) 참조
| STELARA
® |
|||
|---|---|---|---|
| 위약 | 45 mg | 90 mg | |
| 치료 대상자 | 665 | 664 | 666 |
| 비인두염 | 51 (8%) | 56 (8%) | 49 (7%) |
| 상기도 감염 | 30 (5%) | 36 (5%) | 28 (4%) |
| 두통 | 23 (3%) | 33 (5%) | 32 (5%) |
| 피로 | 14 (2%) | 18 (3%) | 17 (3%) |
| 요통 | 8 (1%) | 9 (1%) | 14 (2%) |
| 현기증 | 8 (1%) | 8 (1%) | 14 (2%) |
| 인후통 | 7 (1%) | 9 (1%) | 12 (2%) |
| 가려움증 | 9 (1%) | 10 (2%) | 9 (1%) |
| 주사 부위 홍반 | 3 (<1%) | 6 (1%) | 13 (2%) |
| 근육통 | 4 (1%) | 7 (1%) | 8 (1%) |
| 우울증 | 3 (<1%) | 8 (1%) | 4 (1%) |
Psoriasis 연구 1 및 2의 대조군 기간 12주까지 1% 미만의 발생률로 나타난 이상 반응에는 봉와직염, 대상포진, 게실염 및 특정 주사 부위 반응(통증, 부종, 가려움증, 경화, 출혈, 멍, 자극)이 포함되었습니다.
성인 판상 건선 임상 시험 중 PRES가 한 건 발생했습니다.
[경고 및 주의 사항 (5.6) 참조
감염
판상 건선 환자를 대상으로 한 임상 시험의 위약 대조군 기간(위약 투여 환자의 평균 추적 관찰 기간 12.6주, STELARA
®투여 환자의 평균 추적 관찰 기간 13.4주)에서 STELARA
®투여 환자의 27%(추적 관찰 기간 1인당 연간 1.39건)가 감염을 보고한 반면, 위약 투여 환자의 24%(추적 관찰 기간 1인당 연간 1.21건)가 감염을 보고했습니다. STELARA
®투여 환자의 0.3%(추적 관찰 기간 1인당 연간 0.01건)와 위약 투여 환자의 0.4%(추적 관찰 기간 1인당 연간 0.02건)에서 중대한 감염이 발생했습니다.
[경고 및 주의 사항 (5.1) 참조
판상 건선 임상 시험의 대조군 및 비대조군 부분(중앙값 추적 관찰 기간 3.2년)에서 STELARA
®투여 환자 8998명의 추적 관찰 기간을 나타내는 8998인년 동안 STELARA
®투여 환자의 72.3%(추적 관찰 기간 1인당 연간 0.87건)가 감염을 보고했습니다. 중대한 감염은 환자의 2.8%(추적 관찰 기간 1인당 연간 0.01건)에서 보고되었습니다.
악성 종양
판상 건선 임상 시험의 대조군 및 비대조군 부분(중앙값 추적 관찰 기간 3.2년, 8998인년의 노출을 나타냄)에서 STELARA
®투여 환자의 1.7%가 비흑색종 피부암을 제외한 악성 종양을 보고했습니다(100인년당 0.60건). 비흑색종 피부암은 STELARA
®투여 환자의 1.5%(100인년당 0.52건)에서 보고되었습니다.
[경고 및 주의 사항 (5.4) 참조
임상 시험 중 비흑색종 피부암 이외에 가장 흔하게 관찰된 악성 종양은 전립선암, 흑색종, 대장암 및 유방암이었습니다. 시험의 대조군 및 비대조군 부분에서 STELARA
®투여 환자의 비흑색종 피부암 이외의 악성 종양은 SEER 데이터베이스에 따른 미국 일반 인구에서 예상되는 것과 유형 및 수에서 유사했습니다(연령, 성별 및 인종에 따라 조정).
1
소아 판상 건선 환자
STELARA
®의 안전성은 중등도에서 중증의 판상 건선을 가진 소아 환자를 대상으로 한 두 건의 시험에서 평가되었습니다. Ps 연구 3은 12세에서 17세 사이의 소아 환자 110명을 대상으로 최대 60주 동안 안전성을 평가했습니다. Ps 연구 4는 6세에서 11세 사이의 소아 환자 44명을 대상으로 최대 56주 동안 안전성을 평가했습니다. 소아 환자의 안전성 프로파일은 성인 판상 건선 환자를 대상으로 한 시험의 안전성 프로파일과 유사했습니다.
건선성 관절염
STELARA
®의 안전성은 활동성 건선성 관절염(PsA) 성인 환자를 대상으로 한 두 건의 무작위 이중맹검 위약 대조 시험에서 927명의 환자를 대상으로 평가되었습니다. PsA 환자에서 STELARA
®의 전반적인 안전성 프로파일은 성인 건선 임상 시험에서 관찰된 안전성 프로파일과 일치했습니다. PsA 임상 시험의 위약 대조군 부분에서 STELARA
®투여 환자와 위약 투여 환자를 비교했을 때 관절통, 메스꺼움 및 치과 감염의 발생률이 더 높았습니다(관절통의 경우 3% 대 1%, 메스꺼움의 경우 3% 대 1%, 치과 감염의 경우 1% 대 0.6%).
크론병
STELARA
®의 안전성은 세 건의 무작위 이중맹검 위약 대조 병행군 다기관 시험에서 중등도에서 중증의 활동성 크론병(크론병 활동성 지수[CDAI] 220 이상 450 이하) 환자 1407명을 대상으로 평가되었습니다. 이 1407명의 환자 중에는 이전에 연구용 정맥 주사 ustekinumab 제제를 투여받았지만 효능 분석에는 포함되지 않은 환자 40명이 포함되었습니다. CD-1 및 CD-2 시험에는 체중 기반 단회 정맥 주사 유도 용량으로 STELARA
® 6mg/kg을 투여받은 환자 470명과 위약을 투여받은 환자 466명이 있었습니다.
[용법 및 용량 (2.3) 참조
CD-1 또는 CD-2 시험에서 반응자였던 환자는 CD-3 시험에서 8주마다 90mg의 STELARA
®를 피하 투여하는 유지 요법 또는 위약을 44주 동안 투여받도록 무작위 배정되었습니다. 이 3건의 시험에 참여한 환자는 크론병에 대해 아미노살리실산염, 면역조절제[아자티오프린(AZA), 6-머캡토퓨린(6-MP), 메토트렉세이트(MTX)], 경구 코르티코스테로이드(프레드니손 또는 부데소니드) 및/또는 항생제를 포함한 다른 병용 요법을 투여받았을 수 있습니다.
[임상 연구 (14.4) 참조
STELARA
®의 전반적인 안전성 프로파일은 성인 건선 및 건선성 관절염 임상 시험에서 관찰된 안전성 프로파일과 일치했습니다. CD-1 및 CD-2 시험과 CD-3 시험에서 흔하게 나타난 이상 반응은 각각 표 6과 표 7에 나열되어 있습니다.
| 위약 | STELARA® 6 mg/kg 단회 정맥내 유도 용량 |
|
|---|---|---|
| N=466 | N=470 | |
| 구토 | 3% | 4% |
시험 CD-1 및 CD-2의 대상자에서 보고된 기타 덜 흔한 이상 반응에는 무력증 (1% 대 0.4%), 여드름 (1% 대 0.4%), 및 가려움증 (2% 대 0.4%)이 포함되었습니다.
| 위약 | STELARA® 8주마다 90 mg 피하 유지 용량 |
|
|---|---|---|
| N=133 | N=131 | |
| 비인두염 | 8% | 11% |
| 주사 부위 홍반 | 0 | 5% |
| 외음부 질염/진균 감염 | 1% | 5% |
| 기관지염 | 3% | 5% |
| 가려움증 | 2% | 4% |
| 요로 감염 | 2% | 4% |
| 축농증 | 2% | 3% |
감염
크론병 환자에서 중증 또는 임상적으로 유의한 감염에는 항문 농양, 위장염 및 폐렴이 포함되었습니다. 또한, 리스테리아 수막염과 안구대상포진이 각각 한 명의 환자에게서 보고되었습니다.
[
경고 및 주의사항 (5.1) 참조]
.
악성종양
크론병 임상시험에서 최대 1년간의 치료 후, STELARA
® 치료 대상자의 0.2%(100 환자-연당 0.36건)와 위약 치료 대상자의 0.2%(100 환자-연당 0.58건)에서 비흑색종 피부암이 발생했습니다. 비흑색종 피부암을 제외한 악성종양은 STELARA
® 치료 대상자의 0.2%(100 환자-연당 0.27건)에서 발생했고, 위약 치료 대상자에서는 발생하지 않았습니다.
아나필락시스를 포함한 과민반응
CD 임상시험에서 두 명의 대상자에게서 STELARA
® 투여 후 과민반응이 보고되었습니다. 한 환자는 단일 피하 투여 후 아나필락시스와 일치하는 징후 및 증상(목의 압박감, 호흡곤란 및 홍조)을 경험했습니다(피하 STELARA
®를 투여받은 대상자의 0.1%). 또한, 한 대상자는 초기 정맥내 STELARA
® 용량 투여 후 과민반응과 일치하거나 관련된 징후 및 증상(가슴 불편감, 홍조, 두드러기 및 체온 상승)을 경험했습니다(정맥내 STELARA
®를 투여받은 대상자의 0.08%). 이러한 대상자들은 경구 항히스타민제 또는 코르티코스테로이드로 치료되었으며, 두 경우 모두 증상은 1시간 이내에 해소되었습니다.
궤양성 대장염
STELARA
®의 안전성은 중등도에서 중증의 활동성 궤양성 대장염이 있는 960명의 성인 대상자를 대상으로 한 두 건의 무작위, 이중맹검, 위약 대조 임상시험(UC-1 [정맥내 유도] 및 UC-2 [피하 유지])에서 평가되었습니다.
[
임상시험 (14.5) 참조]
. 궤양성 대장염 환자에서 STELARA
®의 전반적인 안전성 프로파일은 모든 승인된 적응증에서 관찰된 안전성 프로파일과 일치했습니다. STELARA
® 치료 대상자의 3% 이상에서 보고되었고 위약보다 높은 비율로 보고된 유해 반응은 다음과 같습니다.
- 유도(UC-1): 비인두염 (7% 대 4%).
- 유지(UC-2): 비인두염 (24% 대 20%), 두통 (10% 대 4%), 복통 (7% 대 3%), 인플루엔자 (6% 대 5%), 발열 (5% 대 4%), 설사 (4% 대 1%), 부비동염 (4% 대 1%), 피로 (4% 대 2%), 및 오심 (3% 대 2%).
감염
궤양성 대장염 환자에서 중증 또는 임상적으로 유의한 감염에는 위장염 및 폐렴이 포함되었습니다. 또한, 리스테리아증과 안구대상포진이 각각 한 명의 대상자에게서 보고되었습니다.
[
경고 및 주의사항 (5.1) 참조]
.
6.2 면역원성
모든 치료용 단백질과 마찬가지로 면역원성이 발생할 가능성이 있습니다. 항체 형성의 검출은 검사의 민감도와 특이성에 크게 의존합니다. 또한, 검사에서 관찰된 항체(중화 항체 포함) 양성의 발생률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동시 투여 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 아래에 설명된 시험에서 ustekinumab에 대한 항체 발생률을 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
건선 및 건선성 관절염 임상시험에서 STELARA
®로 치료받은 대상자의 약 6~12.4%가 ustekinumab에 대한 항체를 생성했으며, 일반적으로 역가가 낮았습니다. 건선 임상시험에서 ustekinumab에 대한 항체는 감소되거나 검출되지 않는 혈청 ustekinumab 농도 및 감소된 효능과 관련이 있었습니다. 건선 시험에서 ustekinumab에 대한 항체가 양성인 대부분의 대상자는 중화 항체를 가지고 있었습니다.
크론병 및 궤양성 대장염 임상시험에서 각각 약 1년 동안 STELARA
®로 치료받은 대상자의 2.9%와 4.6%가 ustekinumab에 대한 항체를 생성했습니다. ustekinumab에 대한 항체 생성과 주사 부위 반응 발생 사이에는 명확한 연관성이 관찰되지 않았습니다.
6.3 시판 후 경험
STELARA
®의 시판 후 사용 중 다음과 같은 유해 반응이 보고되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되었기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 STELARA
® 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애: 중증 과민반응(아나필락시스 및 안젤오에데마 포함), 기타 과민반응(발진 및 두드러기 포함)
.
감염 및 기생충 감염: 하부 호흡기 감염 (기회 감염성 진균 감염 및 결핵 포함).
신경계 장애: 후방 가역성 뇌병증 증후군 (PRES)
.
호흡기, 흉부 및 종격동 장애:간질성 폐렴, 호산구성 폐렴 및 암호성 기관 형성 폐렴.
피부 반응: 수포성 건선, 홍피증성 건선, 과민성 혈관염.
7 약물 상호 작용
7.1 병용 요법
판상 건선 시험에서 면역억제제 또는 광선 요법과 병용한 STELARA®의 안전성은 평가되지 않았습니다. 건선성 관절염 시험에서 메토트렉세이트(MTX) 병용 사용은 STELARA®의 안전성 또는 효능에 영향을 미치지 않는 것으로 나타났습니다. 크론병 및 궤양성 대장염 유도 시험에서 면역조절제(6-MP, AZA, MTX)는 약 30%의 피험자에게 병용되었고, 코르티코스테로이드는 크론병 및 궤양성 대장염 피험자의 약 40% 및 50%에게 각각 병용되었습니다. 이러한 병용 요법의 사용은 STELARA®의 전반적인 안전성 또는 효능에 영향을 미치지 않는 것으로 나타났습니다.
7.2 CYP450 기질
만성 염증 동안 특정 사이토카인(예: IL-1, IL-6, TNFα, IFN)의 증가된 수치에 의해 CYP450 효소의 생성이 억제될 수 있습니다. 따라서 IL-12 및 IL-23 길항제인 STELARA®의 사용은 CYP450 효소의 생성을 정상화할 수 있습니다. 특히 치료 지수가 좁은 CYP450 기질을 병용 투여받는 환자에서 STELARA®의 투여 시작 또는 중단 시 치료 효과 또는 약물 농도를 모니터링하고 필요에 따라 CYP 기질의 개별 용량을 조정하는 것을 고려하십시오. 특정 CYP 기질의 처방 정보를 참조하십시오.
크론병 환자에서 CYP 매개 약물 상호작용 효과는 관찰되지 않았습니다[임상 약리학 (12.3) 참조].
7.3 알레르겐 면역 요법
알레르기 면역 요법을 받은 환자에서 STELARA®는 평가되지 않았습니다. STELARA®는 알레르겐 면역 요법의 보호 효과(내성 감소)를 감소시켜 알레르겐 면역 요법 용량에 대한 알레르기 반응 위험을 증가시킬 수 있습니다. 따라서 특히 아나필락시스의 경우 알레르겐 면역 요법을 받고 있거나 받았던 환자에게는 주의해야 합니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 중 STELARA® 사용에 대한 관찰 연구, 발표된 사례 보고 및 시판 후 감시 자료는 주요 선천적 기형, 유산 및 기타 모체 또는 태아의 유해 결과와 관련된 약물 위험을 알리기에 충분하지 않습니다. 인간 IgG 항체의 태반 통과는 임신이 진행됨에 따라 증가하여 3분기에 최고조에 달합니다. 따라서 STELARA®는 발달 중인 태아에게 전달될 수 있습니다[임상적 고려 사항 참조]. 동물 생식 및 발달 독성 연구에서, 최대 권장 인체 용량(MRHD)의 100배를 초과하는 용량으로 임신 원숭이에게 ustekinumab을 투여한 후 자손에게 유해한 발달 효과는 관찰되지 않았습니다.
지정된 모집단의 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 유해 결과의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신의 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
자료
동물 자료
Ustekinumab은 시노몰구스 원숭이를 대상으로 한 두 가지 배아-태아 발달 독성 연구에서 시험되었습니다. 기관 형성 기간 동안 ustekinumab을 주 2회 피하 또는 주 1회 정맥 내로 투여받은 임신 원숭이의 태아에서 기형 유발 또는 기타 유해한 발달 효과는 관찰되지 않았습니다. 임신 원숭이의 ustekinumab 혈청 농도는 4주 동안 주 90mg의 ustekinumab을 피하 투여받은 환자의 혈청 농도보다 100배 이상 높았습니다.
결합된 배아-태아 발달 및 출산 전후 발달 독성 연구에서, 임신 시노몰구스 원숭이에게 기관 형성 시작부터 분만 후 33일까지 최대 권장 인체 용량(MRHD)의 100배를 초과하는 용량으로 주 2회 피하 ustekinumab을 투여했습니다. 22.5mg/kg 및 45mg/kg으로 투여받은 원숭이의 자손에서 신생아 사망이 발생했습니다. 출생부터 6개월까지 신생아의 기능적, 형태학적 또는 면역학적 발달에 대한 ustekinumab 관련 효과는 관찰되지 않았습니다.
8.2 수유
위험 요약
발표된 문헌의 제한된 자료에 따르면 ustekinumab은 모유에 존재합니다. ustekinumab이 모유 생산에 미치는 영향에 대한 자료는 없습니다. 모유 수유 영아의 국소 위장관 노출 및 제한된 전신 노출에 대한 ustekinumab의 영향은 알려져 있지 않습니다. 발표된 문헌이나 시판 후 경험에서 ustekinumab과 인과적으로 관련된 모유 수유 영아의 유해 반응은 확인되지 않았습니다.
모유 수유의 발달 및 건강상의 이점은 어머니의 STELARA®에 대한 임상적 필요성과 STELARA® 또는 기저 모체 질환으로 인한 모유 수유 영아에 대한 잠재적인 유해 효과와 함께 고려해야 합니다.
8.4 소아 사용
판상 건선
광선 요법 또는 전신 요법의 후보인 6~17세 소아 환자의 중등도에서 중증 판상 건선 치료에 대한 STELARA®의 안전성 및 유효성이 입증되었습니다.
12세 이상 17세 미만 소아 환자에서 STELARA®의 사용은 110명의 12세 이상 소아 대상자를 포함하는 다기관, 무작위, 60주 시험(Ps STUDY 3)의 증거에 의해 뒷받침됩니다. 이 시험에는 12주 이중맹검, 위약 대조, 병행군 부분이 포함됩니다[유해 반응 (6.1), 임상 연구 (14.2) 참조].
6~11세 소아 환자에서 STELARA®의 사용은 44명의 대상자를 대상으로 한 개방형, 단일군, 유효성, 안전성 및 약동학 시험(Ps STUDY 4)의 증거에 의해 뒷받침됩니다[유해 반응 (6.1), 약동학 (12.3) 참조].
6세 미만 판상 건선 소아 환자에서 STELARA®의 안전성 및 유효성은 입증되지 않았습니다.
건선성 관절염
STELARA® (우스테키누맙 주사, 용액)의 안전성 및 유효성은 6세에서 17세 소아 환자의 건선성 관절염 치료에 대해 확립되었습니다.
이 연령대에서 STELARA®의 사용은 건선 및 PsA 성인 환자에 대한 STELARA®의 적절하고 잘 통제된 시험, 건선 성인 피험자, PsA 성인 피험자 및 건선 소아 피험자에 대한 약동학적 데이터, 그리고 건선을 가진 6세에서 11세 소아 피험자 44명과 건선을 가진 12세에서 17세 소아 피험자 110명에 대한 두 건의 임상 시험의 안전성 데이터를 바탕으로 뒷받침됩니다. 관찰된 투여 전 (최저) 농도는 일반적으로 건선 성인 피험자, PsA 성인 피험자 및 건선 소아 피험자 간에 비교적 유사하며, PK 노출은 PsA 성인 및 소아 피험자 간에 비교적 유사할 것으로 예상됩니다 [유해 반응 (6.1), 임상 약리학 (12.3), 및 임상 연구 (14.1, 14.2, 14.3) 참조].
STELARA®의 안전성 및 유효성은 건선성 관절염을 가진 6세 미만 소아 환자에 대해서는 확립되지 않았습니다.
8.5 노인 사용
STELARA®에 노출된 6709명의 피험자 중 총 340명이 65세 이상이었으며 (플라크 건선 환자 183명, 건선성 관절염 환자 65명, 크론병 환자 58명, 궤양성 대장염 환자 34명), 40명이 75세 이상이었습니다. STELARA®의 임상 시험에는 65세 이상 피험자가 충분하지 않아 연령이 더 젊은 성인 피험자와 반응이 다른지 여부를 확인할 수 없었습니다.
10 과다 복용
임상 시험에서 최대 6 mg/kg까지의 단회 정맥내 투여가 용량 제한적 독성 없이 시행되었습니다. 과량 투여의 경우, 환자에게 유해 반응 또는 효과의 징후나 증상이 있는지 모니터링하고 즉시 적절한 증상 치료를 실시하십시오. 추가적인 과량 투여 관리 권장 사항에 대해서는 Poison Help line (1-800-222-1222) 또는 의학 독성학자에게 문의하는 것을 고려하십시오.
11 설명
우스테키누맙은 사람 IgG1κ 단클론 항체로, 사람 인터루킨-12 및 -23 길항제입니다. DNA 재조합 기술을 사용하여, 우스테키누맙은 마우스 세포주 (Sp2/0)에서 생산됩니다. 제조 공정에는 바이러스 제거 단계가 포함됩니다. 우스테키누맙은 1326개의 아미노산으로 구성되며, 추정 분자량은 148,079~149,690 달톤입니다.
STELARA
®(우스테키누맙) 주사제는 멸균된 방부제가 없는 무색에서 연한 황색 용액이며, pH 5.7~6.3이고 소량의 작고 반투명하거나 흰색의 입자가 포함될 수 있습니다.
STELARA
®피하 주사용
우스테키누맙 45mg이 0.5mL에 함유된 제품과 우스테키누맙 90mg이 1mL에 함유된 제품으로 제공되며, 27 게이지 고정 ½인치 바늘이 부착된 1회용 프리필드 시린지에 멸균 용액 형태로 공급되며, 우스테키누맙 45mg이 0.5mL에 함유된 제품은 코팅 마개가 있는 2mL 1종 유리 바이알에 1회용으로 공급됩니다. 시린지는 수동 바늘 보호대와 건조 천연 고무(라텍스 유도체)가 포함된 바늘 덮개가 장착되어 있습니다.
0.5mL 프리필드 시린지 또는 바이알에는 우스테키누맙 45mg, L-히스티딘 및 L-히스티딘 일염산염 일수화물 (0.5mg), 폴리소르베이트 80 (0.02mg), 수크로스 (38mg)가 함유되어 있습니다.
1mL 프리필드 시린지에는 우스테키누맙 90mg, L-히스티딘 및 L-히스티딘 일염산염 일수화물 (1mg), 폴리소르베이트 80 (0.04mg), 수크로스 (76mg)가 함유되어 있습니다.
STELARA
®정맥 주입용
우스테키누맙 130mg이 26mL에 함유된 제품으로 제공되며, 코팅 마개가 있는 30mL 1종 유리 바이알에 1회용으로 공급됩니다.
26mL 바이알에는 우스테키누맙 130mg, EDTA 이나트륨염 이수화물 (0.52mg), L-히스티딘 (20mg), L-히스티딘 염산염 일수화물 (27mg), L-메티오닌 (10.4mg), 폴리소르베이트 80 (10.4mg), 수크로스 (2210mg)가 함유되어 있습니다.
12 약물동력학
12.1 작용 기전
우스테키누맙은 IL-12 및 IL-23 사이토카인 모두에서 사용되는 p40 단백질 서브유닛에 특이적으로 결합하는 인간 IgG1κ 단클론 항체입니다. IL-12 및 IL-23은 자연 살해 세포 활성화 및 CD4+ T 세포 분화 및 활성화와 같은 염증 및 면역 반응에 관여하는 자연 발생 사이토카인입니다. in vitro 모델에서 우스테키누맙은 이러한 사이토카인과 공유 세포 표면 수용체 사슬인 IL-12Rβ1의 상호 작용을 방해함으로써 IL-12 및 IL-23 매개 신호 전달 및 사이토카인 캐스케이드를 방해하는 것으로 나타났습니다. IL-12 및 IL-23 사이토카인은 크론병과 궤양성 대장염의 특징인 만성 염증에 중요한 기여 요소로 여겨져 왔습니다. 대장염 동물 모델에서 우스테키누맙의 표적이자 IL-12 및 IL-23의 p40 서브유닛의 유전적 부재 또는 항체 차단은 보호 효과가 있는 것으로 나타났습니다.
12.2 약력학
판상 건선
소규모 탐색 시험에서 판상 건선 환자의 병변 피부 생검에서 기준선과 치료 후 최대 2주까지 측정된 분자 표적 IL-12 및 IL-23의 mRNA 발현 감소가 관찰되었습니다.
12.3 약동학
흡수
판상 건선 성인 피험자에서 우스테키누맙 45mg(N=22) 및 90mg(N=24)의 단회 피하 투여 후 최대 혈청 농도에 도달하는 중앙값 시간(T
max)은 각각 13.5일 및 7일이었습니다. 건강한 피험자(N=30)에서 우스테키누맙 90mg의 단회 피하 투여 후 중앙값 T
max값(8.5일)은 판상 건선 피험자에서 관찰된 값과 비슷했습니다.
판상 건선 성인 피험자에서 STELARA
®의 반복 피하 투여 후, 28주차에 우스테키누맙의 정상 상태 혈청 농도에 도달했습니다. 100kg 이하의 피험자에게 45mg 용량을 투여한 경우 평균(±SD) 정상 상태 골 혈청 우스테키누맙 농도는 0.69 ± 0.69 mcg/mL였고, 100kg 초과의 피험자에게 90mg 용량을 투여한 경우 0.74 ± 0.78 mcg/mL였습니다. 12주마다 피하 투여했을 때 혈청 우스테키누맙 농도의 누적은 없었습니다.
권장 정맥내 유도 용량 투여 후, 크론병 환자의 평균 ±SD 최고 혈청 우스테키누맙 농도는 125.2 ± 33.6 mcg/mL였고, 궤양성 대장염 환자는 129.1 ± 27.6 mcg/mL였습니다. 8주차부터 90mg 우스테키누맙의 권장 피하 유지 용량을 8주마다 투여했습니다. 두 번째 유지 용량 투여 시작 시 정상 상태 우스테키누맙 농도에 도달했습니다. 8주마다 피하 투여했을 때 우스테키누맙 농도의 누적은 없었습니다. 8주마다 90mg 우스테키누맙을 투여받은 크론병 환자의 평균 ±SD 정상 상태 골 농도는 2.5 ± 2.1 mcg/mL였고, 궤양성 대장염 환자는 3.3 ± 2.3 mcg/mL였습니다.
분포
모집단 약동학 분석 결과, 크론병 환자의 중앙 구획에서 우스테키누맙의 분포 용적은 2.7L(95% CI: 2.69, 2.78)이었고, 궤양성 대장염 환자는 3.0L(95% CI: 2.96, 3.07)이었습니다. 정상 상태에서 총 분포 용적은 크론병 환자의 경우 4.6L, 궤양성 대장염 환자의 경우 4.4L이었습니다.
배설
피하 투여 후 모든 판상 건선 시험에서 평균(±SD) 반감기는 14.9 ± 4.6일에서 45.6 ± 80.2일까지 다양했습니다. 모집단 약동학 분석 결과, 크론병 환자의 우스테키누맙 청소율은 0.19 L/day(95% CI: 0.185, 0.197)였고, 궤양성 대장염 환자는 0.19 L/day(95% CI: 0.179, 0.192)였으며, IBD(크론병 및 궤양성 대장염) 모집단 모두에 대해 추정 중앙값 최종 반감기는 약 19일이었습니다.
이러한 결과는 크론병 환자와 궤양성 대장염 환자 간에 우스테키누맙의 약동학이 유사함을 나타냅니다.
대사
우스테키누맙의 대사 경로는 특징이 밝혀지지 않았습니다. 인간 IgG1κ 단클론 항체인 우스테키누맙은 내인성 IgG와 같은 방식으로 이화 작용 경로를 통해 작은 펩타이드와 아미노산으로 분해될 것으로 예상됩니다.
특정 집단
체중
같은 용량을 투여받은 경우, 100kg이 넘는 판상 건선 또는 건선성 관절염 환자는 100kg 이하의 환자에 비해 중앙값 혈청 우스테키누맙 농도가 낮았습니다. 90mg 그룹의 체중이 더 나가는 피험자(100kg 초과)의 중앙값 골 혈청 농도는 45mg 그룹의 체중이 적게 나가는 피험자(100kg 이하)의 농도와 비슷했습니다.
연령: 노년층
65세 이상의 판상 건선 환자 (1937명 중 106명)를 대상으로 한 집단 약동학 분석을 통해 연령이 ustekinumab의 약동학에 미치는 영향을 평가했습니다. 65세 이상의 피험자에서 약동학적 매개변수(청소율 및 분포 용적)에 명백한 변화는 없었습니다.
연령: 소아 인구집단
판상 건선이 있는 6~17세 소아 피험자에게 권장 용량의 STELARA
®를 반복 투여한 후, 28주차에 ustekinumab의 정상 상태 혈청 농도에 도달했습니다. 28주차에 소아 피험자의 평균 ± 표준편차 정상 상태 골 혈청 ustekinumab 농도는 6~11세 소아 피험자의 경우 0.36 ± 0.26 mcg/mL, 12~17세 소아 피험자의 경우 0.54 ± 0.43 mcg/mL였습니다.
전반적으로, 판상 건선이 있는 소아 피험자에서 관찰된 정상 상태 ustekinumab 골 농도는 STELARA
®를 투여받은 판상 건선 성인 피험자 및 PsA 성인 피험자에서 관찰된 농도 범위 내에 있었습니다.
약물 상호작용 연구
인간 간세포를 사용한
in vitro 연구에서 IL-12 또는 IL-23이 CYP450 효소 조절에 미치는 영향을 평가한 결과, 10 ng/mL 수준의 IL-12 및/또는 IL-23은 인간 CYP450 효소 활성(CYP1A2, 2B6, 2C9, 2C19, 2D6 또는 3A4)을 변화시키지 않았습니다.
크론병 환자에서 승인된 권장 용량으로 ustekinumab과 병용 투여했을 때 카페인(CYP1A2 기질), 와파린(CYP2C9 기질), 오메프라졸(CYP2C19 기질), 덱스트로메토르판(CYP2D6 기질) 또는 미다졸람(CYP3A 기질)의 노출량에 임상적으로 유의미한 변화는 관찰되지 않았습니다
[
약물 상호작용 (7.2) 참조
.
집단 약동학 분석 결과, 건선성 관절염 환자에서 ustekinumab의 청소율은 병용 투여된 MTX, NSAIDs 및 경구 코르티코스테로이드 또는 TNF 억제제의 이전 노출에 영향을 받지 않았습니다.
크론병 및 궤양성 대장염 환자에서 집단 약동학 분석 결과, 코르티코스테로이드 또는 면역조절제(AZA, 6-MP 또는 MTX)의 병용 투여로 ustekinumab 청소율이 변화하지 않았으며, 이러한 약물의 병용 투여로 혈청 ustekinumab 농도가 영향을 받지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저해
STELARA®의 발암성 또는 돌연변이원성 가능성을 평가하기 위한 동물 연구는 수행되지 않았습니다. 발표된 문헌에 따르면, 이식된 종양을 가진 마우스에 마우스 IL-12를 투여하면 항종양 효과가 나타났으며, IL-12/IL-23p40 녹아웃 마우스 또는 항-IL-12/IL-23p40 항체로 처리된 마우스는 종양에 대한 숙주 방어력이 감소했습니다. 유전적으로 IL-12와 IL-23 또는 IL-12만 결핍되도록 조작된 마우스는 야생형 마우스에 비해 UV 유발 피부암이 더 일찍 그리고 더 자주 발생했습니다. 마우스 모델에서 이러한 실험적 발견이 인간의 악성 종양 위험과 관련이 있는지는 알 수 없습니다.
주 2회 최대 45 mg/kg의 피하 투여량으로 ustekinumab을 투여받은 수컷 시노몰구스 원숭이에서 생식능력에 대한 영향은 관찰되지 않았습니다 (mg/kg 기준으로 MRHD의 45배). 그러나 교미한 암컷에서는 생식능력 및 임신 결과는 평가되지 않았습니다.
주 2회 최대 50 mg/kg의 피하 투여량으로 유사한 IL-12/IL-23p40 항체를 투여받은 암컷 마우스에서 임신 초기 전과 중에 생식능력에 대한 영향은 관찰되지 않았습니다.
13.2 동물 독성 및/또는 약리학
26주 독성 연구에서, 26주 동안 주 2회 45 mg/kg의 ustekinumab을 피하 투여받은 원숭이 10마리 중 1마리에서 세균 감염이 발생했습니다.
14 CLINICAL STUDIES
14.1 성인 판상 건선
두 건의 다기관, 무작위 배정, 이중맹검, 위약 대조 시험(Ps STUDY 1 및 Ps STUDY 2)에는 판상 건선이 있고 최소 체표면적의 10% 이상이 병변에 포함되며, 건선 면적 및 중증도 지수(PASI) 점수가 ≥12이고 광선 요법 또는 전신 요법의 적응증이 있는 18세 이상의 피험자 총 1996명이 등록되었습니다. 구진성, 홍피증성 또는 농포성 건선이 있는 피험자는 시험에서 제외되었습니다.
Ps STUDY 1에는 766명의 피험자가, Ps STUDY 2에는 1230명의 피험자가 등록되었습니다. 이 시험들은 28주차까지 동일한 설계를 사용했습니다. 두 시험 모두에서 피험자들은 위약, 45mg 또는 90mg의 STELARA ®에 동일한 비율로 무작위 배정되었습니다. STELARA ®에 무작위 배정된 피험자들은 체중에 관계없이 0주차, 4주차 및 16주차에 45mg 또는 90mg 용량을 투여받았습니다. 0주차와 4주차에 위약을 투여받도록 무작위 배정된 피험자들은 12주차와 16주차에 STELARA ®(45mg 또는 90mg)를 투여받도록 변경되었습니다.
두 시험 모두에서 모든 치료군의 피험자들은 약 17~18의 중앙값 기준 PASI 점수를 가졌습니다. 기준 PGA 점수는 Ps STUDY 1의 피험자 44%와 Ps STUDY 2의 피험자 40%에서 중등도 또는 중증이었습니다. 모든 피험자의 약 2/3가 이전에 광선 요법을 받았고, 69%가 건선 치료를 위해 이전에 일반적인 전신 또는 생물학적 치료를 받았으며, 56%가 이전에 일반적인 전신 치료를 받았고 43%가 이전에 생물학적 치료를 받았습니다. 피험자의 총 28%는 건선성 관절염 병력이 있었습니다.
두 시험 모두에서 종점은 기준 시점부터 12주차까지 PASI 점수가 최소 75% 감소한 피험자의 비율(PASI 75)과 의사 전반적 평가(PGA)에서 치료 성공(완치 또는 최소)이었습니다. PGA는 0(완치)에서 5(중증)까지의 6단계 척도로, 판의 두께/경화, 홍반 및 인설에 중점을 둔 건선에 대한 의사의 전반적인 평가를 나타냅니다.
임상 반응
Ps STUDY 1과 Ps STUDY 2의 결과는 아래 표 8에 제시되어 있습니다.
| Ps STUDY 1 | Ps STUDY 2 | |||||
|---|---|---|---|---|---|---|
| STELARA
® |
STELARA
® |
|||||
| 위약 | 45mg | 90mg | 위약 | 45mg | 90mg | |
| 무작위 배정된 피험자 | 255 | 255 | 256 | 410 | 409 | 411 |
| PASI 75 반응 | 8 (3%) | 171 (67%) | 170 (66%) | 15 (4%) | 273 (67%) | 311 (76%) |
| 완치 또는 최소 PGA | 10 (4%) | 151 (59%) | 156 (61%) | 18 (4%) | 277 (68%) | 300 (73%) |
연령, 성별 및 인종 하위 집단에 대한 검사에서 이러한 하위 집단 간 STELARA®에 대한 반응의 차이점은 확인되지 않았습니다.
체중이 100kg 이하인 피험자의 경우 45mg 및 90mg 용량 모두에서 반응률이 비슷했습니다. 그러나 체중이 100kg을 초과하는 피험자의 경우 45mg 용량과 비교하여 90mg 용량에서 더 높은 반응률이 관찰되었습니다(아래 표 9 참조).
| 건선 연구 1 | 건선 연구 2 | |||||
|---|---|---|---|---|---|---|
| STELARA
® |
STELARA
® |
|||||
| 플라시보 | 45mg | 90mg | 플라시보 | 45mg | 90mg | |
|
||||||
| 무작위 배정된 피험자 | 255 | 255 | 256 | 410 | 409 | 411 |
| PASI 75 반응 | ||||||
| ≤100kg | 4% | 74% | 65% | 4% | 73% | 78% |
| 6/166 | 124/168 | 107/164 | 12/290 | 218/297 | 225/289 | |
| >100kg | 2% | 54% | 68% | 3% | 49% | 71% |
| 2/89 | 47/87 | 63/92 | 3/120 | 55/112 | 86/121 | |
| 소실 또는 최소 PGA | ||||||
| ≤100kg | 4% | 64% | 63% | 5% | 74% | 75% |
| 7/166 | 108/168 | 103/164 | 14/290 | 220/297 | 216/289 | |
| >100kg | 3% | 49% | 58% | 3% | 51% | 69% |
| 3/89 | 43/87 | 53/92 | 4/120 | 57/112 | 84/121 | |
Ps STUDY 1에서 28주차와 40주차 모두 PASI 75 반응자였던 대상자들은 40주차에 STELARA® (40주차 STELARA®) 계속 투여군 또는 치료 중단군(40주차 위약)으로 재무작위 배정되었습니다. 52주차에 STELARA® 치료군으로 재무작위 배정된 대상자의 89%(144/162)가 PASI 75 반응자였던 반면, 위약군(28주차 투여 후 치료 중단)으로 재무작위 배정된 대상자는 63%(100/159)였습니다. 치료 중단군으로 무작위 배정된 대상자의 PASI 75 반응 소실까지의 중앙값 기간은 16주였습니다.
14.2 소아 판상 건선
다기관, 무작위, 이중맹검, 위약 대조 시험(Ps STUDY 3)에는 광선 요법 또는 전신 요법의 적응증이 있고 국소 요법으로 질병이 적절히 조절되지 않은 최소 10%의 BSA 병변, 12 이상의 PASI 점수 및 3 이상의 PGA 점수를 가진 12~17세 소아 대상자 110명이 등록되었습니다.
대상자들은 위약(n=37), 권장 용량의 STELARA®(n=36) 또는 권장 용량의 1/2 STELARA®(n=37)을 0주차와 4주차에 피하 주사로 투여받은 후 12주마다(q12w) 투여받는 군으로 무작위 배정되었습니다. STELARA®의 권장 용량은 체중이 60kg 미만인 대상자의 경우 0.75mg/kg, 체중이 60kg~100kg인 대상자의 경우 45mg, 체중이 100kg 초과인 대상자의 경우 90mg이었습니다. 12주차에 위약을 투여받은 대상자들은 권장 용량 또는 권장 용량의 1/2 STELARA®를 투여받도록 교차 투여되었습니다.
소아 대상자 중 약 63%는 광선 요법 또는 기존 전신 요법을 이전에 받은 경험이 있었고, 약 11%는 생물학적 제제를 이전에 받은 경험이 있었습니다.
종점은 12주차에 완치(0) 또는 최소(1)의 PGA 점수, PASI 75 및 PASI 90에 도달한 대상자의 비율이었습니다. 대상자들은 시험 약제의 첫 투여 후 최대 60주까지 추적 관찰되었습니다.
14.3 건선성 관절염
STELARA®의 안전성 및 유효성은 활동성 건선성 관절염(비스테로이드성 항염증제(NSAID) 또는 질병변형 항류마티스제(DMARD) 치료에도 불구하고 붓는 관절 5개 이상 및 압통이 있는 관절 5개 이상)이 있는 18세 이상 성인 대상자 927명(PsA 연구 1, n=615; PsA 연구 2, n=312)을 대상으로 한 두 건의 무작위 배정, 이중맹검, 위약 대조 시험에서 평가되었습니다. 이러한 시험의 대상자들은 최소 6개월 동안 건선성 관절염 진단을 받았습니다. 류마티스 결절이 없는 다관절염(39%), 말초 관절염을 동반한 척추염(28%), 비대칭성 말초 관절염(21%), 원위 지간 관절 병변(12%) 및 관절 파괴(0.5%)를 포함하여 각 건선성 관절염 아형의 대상자들이 등록되었습니다. 환자의 70% 이상 및 40%는 각각 기준 시점에 족저근막염 및 지증염을 보였습니다.
대상자들은 0주차와 4주차에 피하 주사로 STELARA® 45mg, 90mg 또는 위약을 투여받도록 무작위 배정되었으며, 그 후 12주마다(q12w) 투여했습니다. 대상자의 약 50%는 안정적인 용량의 MTX(≤25mg/주)를 계속 복용했습니다. 1차 종점은 24주차에 ACR 20 반응을 달성한 대상자의 비율이었습니다.
PsA 연구 1과 PsA 연구 2에서 각각 80%와 86%의 대상자가 이전에 DMARD로 치료받은 경험이 있었습니다. PsA 연구 1에서는 종양괴사인자(TNF)-α 작용제로의 이전 치료가 허용되지 않았습니다. PsA 연구 2에서는 58%(n=180)의 대상자가 이전에 TNF 차단제로 치료받은 경험이 있었으며, 그중 70% 이상이 효능 부족 또는 내약성 불량으로 언제든지 TNF 차단제 치료를 중단했습니다.
임상 반응
두 시험 모두에서 24주차에 위약군에 비해 STELARA® 45mg 및 90mg 군에서 더 많은 비율의 대상자가 ACR 20, ACR 50 및 PASI 75 반응을 달성했습니다(표 11 참조). ACR 70 반응 또한 STELARA® 45mg 및 90mg 군에서 더 높았지만, 그 차이는 연구 2에서는 수치상의 차이만 있었습니다(p=NS). STELARA® 단독 또는 메토트렉세이트 병용 치료를 받은 대상자에서 반응은 일관되었습니다. 이전 TNFα 노출 여부에 관계없이 대상자의 반응은 유사했습니다.
| PsA 연구 1 | PsA 연구 2 | |||||
|---|---|---|---|---|---|---|
| STELARA® | STELARA® | |||||
| 위약 | 45mg | 90mg | 위약 | 45mg | 90mg | |
|
||||||
| 무작위 배정된 대상자 수 | 206 | 205 | 204 | 104 | 103 | 105 |
| ACR 20 반응, N (%) | 47 (23%) | 87 (42%) | 101 (50%) | 21 (20%) | 45 (44%) | 46 (44%) |
| ACR 50 반응, N (%) | 18 (9%) | 51 (25%) | 57 (28%) | 7 (7%) | 18 (17%) | 24 (23%) |
| ACR 70 반응, N (%) | 5 (2%) | 25 (12%) | 29 (14%) | 3 (3%) | 7 (7%) | 9 (9%) |
| ≥ 3% BSA가 있는 대상자 수 * |
146 | 145 | 149 | 80 | 80 | 81 |
| PASI 75 반응, N (%) | 16 (11%) | 83 (57%) | 93 (62%) | 4 (5%) | 41 (51%) | 45 (56%) |
방문별 ACR 20 반응을 달성한 대상자의 비율은 그림 1에 나와 있습니다.
| 그림 1: 24주차까지 ACR 20 반응을 달성한 대상자의 비율 |
|---|
| PsA 연구 1 |
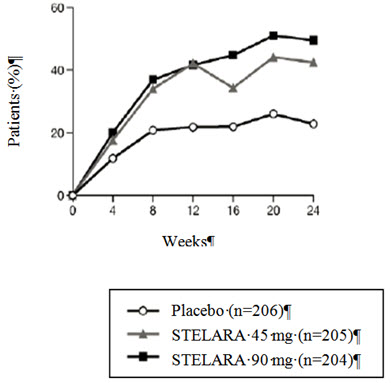 |
ACR 반응 기준 구성 요소의 결과는 표 12에 나와 있습니다.
| PsA 연구 1 | |||
|---|---|---|---|
| STELARA
® |
|||
| 플라세보 (N = 206) |
45 mg (N = 205) |
90 mg (N = 204) |
|
| 부어오른 관절 수 | |||
| 기준선 | 15 | 12 | 13 |
| 24주차 평균 변화 | -3 | -5 | -6 |
| 압통이 있는 관절 수 | |||
| 기준선 | 25 | 22 | 23 |
| 24주차 평균 변화 | -4 | -8 | -9 |
| 피험자의 통증 평가 | |||
| 기준선 | 6.1 | 6.2 | 6.6 |
| 24주차 평균 변화 | -0.5 | -2.0 | -2.6 |
| 피험자 전반적 평가 | |||
| 기준선 | 6.1 | 6.3 | 6.4 |
| 24주차 평균 변화 | -0.5 | -2.0 | -2.5 |
| 의사 전반적 평가 | |||
| 기준선 | 5.8 | 5.7 | 6.1 |
| 24주차 평균 변화 | -1.4 | -2.6 | -3.1 |
| 장애 지수 (HAQ) | |||
| 기준선 | 1.2 | 1.2 | 1.2 |
| 24주차 평균 변화 | -0.1 | -0.3 | -0.4 |
| CRP (mg/dL) | |||
| 기준선 | 1.6 | 1.7 | 1.8 |
| 24주차 평균 변화 | 0.01 | -0.5 | -0.8 |
24주차에 위약과 비교하여 각 STELARA®군에서 활액낭염 및 지관절염 점수의 개선이 관찰되었습니다.
14.4 크론병
STELARA®는 중등도에서 중증의 활동성 크론병(크론병 활동성 지수 [CDAI] 점수 220~450) 성인 대상자를 대상으로 한 3건의 무작위 배정, 이중맹검, 위약 대조 임상시험에서 평가되었습니다. 8주 정맥내 유도 시험(CD-1 및 CD-2) 2건에 이어 44주 피하 무작위 배정 중단 유지 시험(CD-3)이 진행되어 총 52주간의 치료가 이루어졌습니다. CD-1의 대상자는 하나 이상의 TNF 억제제 치료에 실패하거나 내약성이 없었던 반면, CD-2의 대상자는 면역조절제 또는 코르티코스테로이드 치료에 실패하거나 내약성이 없었지만 TNF 억제제 치료에는 실패한 적이 없었습니다.
임상시험 CD-1 및 CD-2
임상시험 CD-1 및 CD-2에서 1409명의 대상자가 무작위 배정되었으며, 그중 1368명(CD-1, n=741; CD-2, n=627)이 최종 효능 분석에 포함되었습니다. 6주차의 임상적 반응 유도(CDAI 점수가 100점 이상 감소하거나 CDAI 점수가 150 미만인 것으로 정의) 및 8주차의 임상적 관해(CDAI 점수가 150 미만인 것으로 정의)를 평가했습니다. 두 임상시험 모두에서 대상자는 약 6mg/kg의 STELARA®를 단회 정맥내 투여받거나 위약(표 4 참조) 또는 130mg(권장 용량보다 낮은 용량)을 투여받도록 무작위 배정되었습니다.
임상시험 CD-1에서 대상자는 이전에 TNF 억제제 치료에 실패하거나 내약성이 없었습니다. 29%의 대상자가 초기 반응이 불충분했고(일차적 비반응자), 69%는 반응했지만 그 후 반응이 사라졌으며(이차적 비반응자), 36%는 TNF 억제제에 대한 내약성이 없었습니다. 이러한 대상자 중 48%는 하나의 TNF 억제제 치료에 실패하거나 내약성이 없었고, 52%는 이전에 2개 또는 3개의 TNF 억제제 치료에 실패했습니다. 기준 시점과 임상시험 전반에 걸쳐 대상자의 약 46%가 코르티코스테로이드를 투여받고 있었고, 31%는 면역조절제(AZA, 6-MP, MTX)를 투여받고 있었습니다. STELARA® 약 6mg/kg 군의 기준 CDAI 점수 중앙값은 319였고, 위약군은 313이었습니다.
임상시험 CD-2에서 대상자는 이전에 코르티코스테로이드(81%의 대상자), 적어도 하나 이상의 면역조절제(6-MP, AZA, MTX; 68%의 대상자) 또는 둘 다(49%의 대상자) 치료에 실패하거나 내약성이 없었습니다. 또한, 69%는 TNF 억제제를 투여받은 적이 없었고, 31%는 이전에 투여받았지만 TNF 억제제 치료에 실패한 적이 없었습니다. 기준 시점과 임상시험 전반에 걸쳐 대상자의 약 39%가 코르티코스테로이드를 투여받고 있었고, 35%는 면역조절제(AZA, 6-MP, MTX)를 투여받고 있었습니다. STELARA®군의 기준 CDAI 점수 중앙값은 286이었고, 위약군은 290이었습니다.
이러한 유도 임상시험에서 권장 용량(약 6mg/kg)의 STELARA®로 치료받은 대상자는 위약과 비교하여 6주차에 임상적 반응을 달성하고 8주차에 임상적 관해에 도달한 비율이 더 높았습니다(임상적 반응 및 관해율은 표 13 참조). STELARA®로 치료받은 대상자의 경우 3주차부터 임상적 반응과 관해가 유의미하게 나타났으며 8주차까지 계속 개선되었습니다.
| CD-1 n = 741 |
CD-2 n = 627 |
|||||
|---|---|---|---|---|---|---|
| 위약 N = 247 |
STELARA®‡ N = 249 |
치료 차이 및 95% CI | 위약 N = 209 |
STELARA®‡ N = 209 |
치료 차이 및 95% CI | |
| 임상적 관해는 CDAI 점수 < 150으로 정의됩니다. 임상적 반응은 CDAI 점수가 100점 이상 감소하거나 임상적 관해 상태인 것으로 정의됩니다. 70점 반응은 CDAI 점수가 70점 이상 감소하는 것으로 정의됩니다. | ||||||
| 6주차 임상 반응(100점), | 53 (21%) | 84 (34%) § |
12% (4%, 20%) |
60 (29%) | 116 (56%) ¶ |
27% (18%, 36%) |
| 8주차 임상 관해 | 18 (7%) | 52 (21%) ¶ |
14% (8%, 20%) |
41 (20%) | 84 (40%) ¶ |
21% (12%, 29%) |
| 8주차 임상 반응(100점) | 50 (20%) | 94 (38%) ¶ |
18% (10%, 25%) |
67 (32%) | 121 (58%) ¶ |
26% (17%, 35%) |
| 70점 반응, 6주차 | 75 (30%) | 109 (44%) § |
13% (5%, 22%) |
81 (39%) | 135 (65%) ¶ |
26% (17%, 35%) |
| 70점 반응, 3주차 | 67 (27%) | 101 (41%) § |
13% (5%, 22%) |
66 (32%) | 106 (51%) ¶ |
19% (10%, 28%) |
시험 CD-3
유지 요법 시험(CD-3)에서는 시험 CD-1 또는 CD-2에서 STELARA
®의 유도 용량으로 8주차에 임상 반응(CDAI 점수 100점 이상 감소)을 달성한 388명의 대상자를 평가했습니다. 대상자들은 44주 동안 8주마다 90mg STELARA
® 또는 위약을 피하 유지 요법으로 투여받도록 무작위 배정되었습니다(
표 14 참조).
| 위약 | 8주마다 90mg STELARA
® |
치료 차이 및 95% CI | |
|---|---|---|---|
| N = 131 | N = 128 | ||
| 임상 관해는 CDAI 점수 < 150으로 정의되며, 임상 반응은 CDAI 감소가 100점 이상이거나 임상 관해 상태인 것으로 정의됩니다. | |||
| 임상 관해 | 47 (36%) | 68 (53%) | 17% (5%, 29%) |
| 임상 반응 | 58 (44%) | 76 (59%) | 15% (3%, 27%) |
| 유지 요법 시작 시 관해 상태였던 환자의 임상 관해 | 36/79 (46%) | 52/78 (67%) | 21% (6%, 36%) |
44주차에 STELARA®를 투여받은 대상자의 47%가 코르티코스테로이드 없이 임상적 관해 상태에 있었던 반면, 위약군에서는 30%였습니다.
CD-3 시험의 0주차에, 이전에 TNF 억제제 치료에 실패하거나 내약성이 없었던 STELARA® 치료 대상자 56명 중 34명(61%)이 임상적 관해 상태였으며, 이들 중 23명(41%)이 44주차에 임상적 관해 상태였습니다. 위약군에서는 61명 중 27명(44%)이 0주차에 임상적 관해 상태였으며, 이들 중 16명(26%)이 44주차에 관해 상태였습니다.
CD-3 시험의 0주차에, 이전에 면역조절제 치료 또는 코르티코스테로이드(그러나 TNF 억제제는 아님)에 실패했던 STELARA® 치료 대상자 72명 중 46명(64%)이 임상적 관해 상태였으며, 이들 중 45명(63%)이 44주차에 임상적 관해 상태였습니다. 위약군에서는 이들 대상자 70명 중 50명(71%)이 0주차에 임상적 관해 상태였으며, 31명(44%)이 44주차에 관해 상태였습니다. TNF 억제제 치료를 받지 않은 이들 대상자의 하위 집단에서, STELARA® 치료 대상자 52명 중 34명(65%)이 44주차에 임상적 관해 상태였던 반면, 위약군에서는 51명 중 25명(49%)이었습니다.
STELARA® 유도 후 8주 이내에 임상적 반응을 보이지 않은 대상자는 CD-3 시험의 1차 유효성 분석에 포함되지 않았습니다. 그러나 이들 대상자는 CD-3 시험 참여 시 90mg의 STELARA® 피하 주사를 투여받을 자격이 있었습니다. 이들 대상자 중 219명 중 102명(47%)이 8주 후 임상적 반응을 보였으며, 시험 기간 동안 추적 관찰되었습니다.
14.5 궤양성 대장염
STELARA®는 생물학적 제제(즉, TNF 억제제 및/또는 베돌리주맙), 코르티코스테로이드 및/또는 6-MP 또는 AZA 치료에 대한 반응이 불충분하거나 내약성이 없었던 중등도에서 중증의 활동성 궤양성 대장염 성인 대상자를 대상으로 한 두 건의 무작위 배정, 이중 눈가림, 위약 대조 임상 시험[UC-1 및 UC-2 (NCT02407236)]에서 평가되었습니다. 8주 정맥 유도 시험(UC-1) 후 44주 피하 무작위 배정 중단 유지 시험(UC-2)이 진행되어 총 52주간의 치료가 이루어졌습니다.
질병 평가는 메이요 점수를 기준으로 했으며, 이 점수는 0~12의 범위이며, 각각 0(정상)에서 3(가장 심각)까지 점수가 매겨지는 4가지 하위 점수(변 배설 빈도, 직장 출혈, 중앙 검토 내시경 검사 결과, 의사 전반적 평가)로 구성됩니다. 중등도에서 중증의 활동성 궤양성 대장염은 기준(0주차) 시 메이요 점수 6~12, 메이요 내시경 하위 점수 ≥2로 정의되었습니다. 내시경 점수 2는 현저한 홍반, 혈관 패턴 없음, 취약성, 미란으로 정의되었으며, 점수 3은 자발적 출혈, 궤양으로 정의되었습니다. 기준 시 대상자의 중앙값 메이요 점수는 9였으며, 대상자의 84%가 중등도 질병(메이요 점수 6~10), 15%가 중증 질병(메이요 점수 11~12)을 앓고 있었습니다.
이들 시험의 대상자는 아미노살리실레이트, 면역조절제(AZA, 6-MP 또는 MTX) 및 경구 코르티코스테로이드(프레드니손)를 포함한 다른 병용 요법을 받았을 수 있습니다.
UC-1 시험
UC-1에서 961명의 대상자가 0주차에 약 6mg/kg, 130mg(권장 용량보다 낮음)의 STELARA® 단회 정맥 투여 또는 위약을 무작위 배정받았습니다. UC-1에 등록된 대상자는 코르티코스테로이드, 면역조절제 또는 적어도 하나의 생물학적 제제 치료에 실패해야 했습니다. 총 51%가 적어도 하나의 생물학적 제제 치료에 실패했고, 17%가 TNF 억제제와 인테그린 수용체 억제제 모두에 실패했습니다. 전체 모집단 중 46%가 코르티코스테로이드 또는 면역조절제 치료에 실패했지만 생물학적 제제 치료를 받지 않았고, 추가로 3%가 이전에 생물학적 제제를 투여받았지만 실패하지는 않았습니다. 유도 기준 시점과 시험 전반에 걸쳐 대상자의 약 52%가 경구 코르티코스테로이드를, 28%가 면역조절제(AZA, 6-MP 또는 MTX)를, 69%가 아미노살리실레이트를 투여받았습니다.
1차 종점은 8주차의 임상적 관해였습니다. 메이요 변 배설 빈도 하위 점수 0 또는 1, 메이요 직장 출혈 하위 점수 0(직장 출혈 없음), 메이요 내시경 하위 점수 0 또는 1(메이요 내시경 하위 점수 0은 정상 또는 비활동성 질병으로 정의되고 메이요 하위 점수 1은 홍반, 감소된 혈관 패턴 및 취약성 없음으로 정의됨)로 정의되는 임상적 관해는 표 15에 제시되어 있습니다.
2차 종점은 임상적 반응, 내시경적 개선 및 조직학적-내시경적 점막 개선이었습니다.(의사 전반적 평가를 제외한 3가지 구성 요소 메이요 점수로 정의되는 수정된 메이요 점수에서 ≥2점 및 ≥30% 감소, 직장 출혈 하위 점수에서 기준 대비 감소 ≥1 또는 직장 출혈 하위 점수 0 또는 1로 정의되는) 임상적 반응, 메이요 내시경 하위 점수 0 또는 1로 정의되는 내시경적 개선, 결합된 내시경적 개선 및 결장 조직의 조직학적 개선[소포 침윤 <5%, 소포 파괴 없음, 미란, 궤양 또는 과립 조직 없음]으로 정의되는 조직학적-내시경적 점막 개선은 표 15에 제시되어 있습니다.
UC-1에서 STELARA®(약 6mg/kg 용량으로 권장되는 용량)로 치료받은 대상자 중 위약보다 임상적 관해 및 반응에 도달하고 내시경적 개선 및 조직학적-내시경적 점막 개선을 달성한 비율이 유의하게 높았습니다( 표 15 참조).
| 종점 |
위약 N = 319 |
STELARA
®* |
치료 차이 및 97.5% CI | ||
|---|---|---|---|---|---|
| N | % | N | % | ||
|---|---|---|---|---|---|
|
|||||
| 임상적 관해 ‡ |
22 | 7% | 62 | 19% | 12% (7%, 18%) |
| 생물학적 치료 경험 없음 ¶ |
14/151 | 9% | 36/147 | 24% | |
| 이전 생물학적 치료 실패 | 7/161 | 4% | 24/166 | 14% | |
| 내시경적 개선 # |
40 | 13% | 80 | 25% | 12% (6%, 19%) |
| 생물학적 치료 경험 없음 ¶ |
28/151 | 19% | 43/147 | 29% | |
| 이전 생물학적 치료 실패 | 11/161 | 7% | 34/166 | 20% | |
| 임상적 반응 Þ |
99 | 31% | 186 | 58% | 27% (18%, 35%) |
| 생물학적 치료 경험 없음 ¶ |
55/151 | 36% | 94/147 | 64% | |
| 이전 생물학적 치료 실패 | 42/161 | 26% | 86/166 | 52% | |
| 조직학적-내시경적 점막 개선 ß |
26 | 8% | 54 | 17% | 9% (3%, 14%) |
| 생물학적 치료 경험 없음 ¶ |
19/151 | 13% | 30/147 | 20% | |
| 이전 생물학적 치료 실패 | 6/161 | 4% | 21/166 | 13% | |
UC-1에서 8주차에 정의된 조직학적-내시경적 점막 개선과 질병 진행 및 장기 결과와의 관계는 UC-1 기간 동안 평가되지 않았습니다.
UC-2 시험
유지 시험(UC-2)에서는 UC-1에서 STELARA
®의 유도 용량 정맥 투여 후 8주 만에 임상적 반응을 보인 523명의 대상자를 평가했습니다. 이러한 대상자들은 8주마다 90mg의 STELARA
®피하 유지 요법 또는 12주마다(권장 용량보다 낮음) 또는 위약을 44주 동안 투여받도록 무작위 배정되었습니다.
주요 평가 지표는 44주차에 임상적 관해 상태에 있는 대상자의 비율이었습니다. 이차 평가 지표에는 44주차에 임상적 반응을 유지하는 대상자의 비율, 44주차에 내시경적 개선을 보이는 대상자의 비율, 44주차에 코르티코스테로이드 없는 임상적 관해 상태에 있는 대상자의 비율, 그리고 유도 후 8주 만에 임상적 관해 상태에 도달한 대상자 중 44주차에 임상적 관해 상태를 유지하는 대상자의 비율이 포함되었습니다.
권장 용량(8주마다 90mg)으로 STELARA
® 치료를 받은 대상자에서 위약과 비교한 44주차 주요 및 이차 평가 지표 결과는 표 16에 나와 있습니다.
| 평가 지표 | 위약
* |
8주마다 90mg STELARA
® |
치료 차이 및 95% CI | ||
|---|---|---|---|---|---|
| N | % | N | % | ||
|
|||||
| 임상적 관해 | 46 | 26% | 79 | 45% | 19% (9%, 28%) |
| 생물학적 제제 미경험자 | 30/84 | 36% | 39/79 | 49% | |
| 생물학적 제제 실패 경험자 | 16/88 | 18% | 37/91 | 41% | |
| 44주차 임상적 반응 유지 | 84 | 48% | 130 | 74% | 26% (16%, 36%) |
| 생물학적 치료제 미경험자 | 49/84 | 58% | 62/79 | 78% | |
| 생물학적 치료제 치료 실패 경험자 | 35/88 | 40% | 64/91 | 70% | |
| 내시경적 개선 | 47 | 27% | 83 | 47% | 20% (11%, 30%) |
| 생물학적 치료제 미경험자 | 29/84 | 35% | 42/79 | 53% | |
| 생물학적 치료제 치료 실패 경험자 | 18/88 | 20% | 38/91 | 42% | |
| 코르티코스테로이드 무첨가 임상적 관해 | 45 | 26% | 76 | 43% | 17% (8%, 27%) |
| 생물학적 치료제 미경험자 | 30/84 | 36% | 38/79 | 48% | |
| 생물학적 치료제 치료 실패 경험자 | 15/88 | 17% | 35/91 | 38% | |
| 유도 요법 후 8주 후 임상적 관해를 달성한 대상자에서 44주차 임상적 관해 유지 | 18/50 | 36% | 27/41 | 66% | 31% (12%, 50%) |
| 생물학적 치료제 미경험자 | 12/27 | 44% | 14/20 | 70% | |
| 생물학적 치료제 치료 실패 경험자 | 6/23 | 26% | 12/18 | 67% | |
기타 평가변수
우스테키누맙 유도 요법 16주차 반응자
UC-1에서 STELARA
®유도 요법 후 8주 후 임상적 반응을 보이지 않은 대상자는 시험 UC-2의 1차 유효성 분석에 포함되지 않았습니다. 그러나 이러한 대상자는 8주차에 90mg의 STELARA
®피하 주사를 투여받을 자격이 있었습니다. 이러한 대상자 중 55/101명(54%)이 8주 후(16주차)에 임상적 반응을 보였으며, UC-2 시험 기간 동안 8주마다 90mg의 STELARA
®피하 주사를 투여받았습니다. 44주차에 임상적 반응을 유지한 대상자는 97/157명(62%)이었고, 임상적 관해를 달성한 대상자는 51/157명(32%)이었습니다.
15 참고 문헌
- Surveillance, Epidemiology, and End Results (SEER) Program (www.seer.cancer.gov) SEER*Stat Database: Incidence – SEER 6.6.2 Regs Research Data, Nov 2009 Sub (1973–2007) – Linked To County Attributes – Total U.S., 1969–2007 Counties, National Cancer Institute, DCCPS, Surveillance Research Program, Surveillance Systems Branch, released April 2010, based on the November 2009 submission.
16 제공/보관 및 취급 방법
STELARA
®(우스테키누맙) 주사제는 멸균된 방부제가 없는 무색에서 연한 황색의 용액이며, 소량의 작고 반투명하거나 흰색의 입자가 포함될 수 있습니다. 개별 포장된 1회용량 프리필드 시린지 또는 1회용량 바이알로 공급됩니다.
피하 사용
프리필드 시린지
- 45 mg/0.5 mL (NDC 57894-060-03)
- 90 mg/mL (NDC 57894-061-03)
각 프리필드 시린지는 27 게이지 고정 ½인치 바늘, 바늘 안전 가드 및 건조 천연 고무가 포함된 바늘 덮개를 갖추고 있습니다.
1회용량 바이알
- 45 mg/0.5 mL (NDC 57894-060-02)
보관 및 안정성
STELARA
®바이알 및 프리필드 시린지는 2°C~8°C(36°F~46°F)의 냉장 보관하십시오. STELARA
®바이알은 바로 세워 보관하십시오. 사용할 때까지 제품을 원래의 상자에 보관하여 빛으로부터 보호하십시오. 동결하지 마십시오. 흔들지 마십시오.
필요한 경우, 개별 프리필드 시린지는 최대 30일 동안 최대 30°C(86°F)의 실온에서 원래 상자에 보관하여 빛으로부터 보호할 수 있습니다. 냉장고에서 프리필드 시린지를 처음 꺼낸 날짜를 제공된 공간에 상자에 기록하십시오. 시린지를 실온에 보관한 후에는 냉장고에 다시 넣지 마십시오. 실온 보관 후 30일 이내에 사용하지 않은 시린지는 버리십시오. 상자 또는 프리필드 시린지에 표시된 유효기간이 지난 STELARA
®는 사용하지 마십시오.
17 환자 상담 정보
FDA 승인 환자용 설명서(의약품 안내서 및 사용법)를 환자 및/또는 보호자에게 읽도록 안내하십시오.
감염
STELARA®는 환자의 면역 체계가 감염과 싸우는 능력을 낮출 수 있으므로, 감염의 징후나 증상이 나타나면 즉시 의료 제공자에게 연락하도록 환자에게 알리십시오 [경고 및 주의 사항 (5.1) 참조].
과민 반응
- 중증 과민 반응의 징후나 증상이 나타나면 즉시 의료기관의 도움을 받고 STELARA® 투여를 중단하도록 환자에게 알리십시오 [경고 및 주의 사항 (5.5) 참조].
- 사전 충전 주사기에 있는 바늘 덮개에는 건조 천연 고무(라텍스 유도체)가 포함되어 있어 라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있음을 환자에게 알리십시오 [투여 및 관리 (2.4) 참조].
후방 가역성 뇌병증 증후군 (PRES)
PRES의 징후 및 증상(두통, 발작, 혼란 또는 시각 장애 포함)이 나타나면 즉시 의료 제공자에게 연락하도록 환자에게 알리십시오 [경고 및 주의 사항 (5.6) 참조].
SPL 미분류 섹션
프리필드 시린지 제조사: Janssen Biotech, Inc., Horsham, PA 19044, 미국 허가 번호 1864 (Baxter Pharmaceutical Solutions, Bloomington, IN 47403 및 Cilag AG, Schaffhausen, 스위스에서 제조)
바이알 제조사: Janssen Biotech, Inc., Horsham, PA 19044, 미국 허가 번호 1864 (Cilag AG, Schaffhausen, 스위스에서 제조)
© 2012, 2016, 2019 Janssen Pharmaceutical Companies
약물 안내문
| 본 의약품 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 3월 | ||
| 의약품 설명서 STELARA ®(스텔라) (우스테키누맙) 피하 또는 정맥 주사용 주사액 |
|||
| STELARA에 대해 가장 중요한 정보는 무엇입니까? STELARA는 면역 체계에 영향을 미치는 약물입니다. STELARA는 다음을 포함한 심각한 부작용의 위험을 증가시킬 수 있습니다. 심각한 감염.STELARA는 면역 체계의 감염과 싸우는 능력을 낮추고 감염 위험을 증가시킬 수 있습니다. 일부 사람들은 STELARA를 복용하는 동안 결핵(TB)을 포함한 박테리아, 곰팡이 또는 바이러스에 의한 감염과 같은 심각한 감염을 경험했습니다. 일부 사람들은 감염 치료를 위해 입원해야 했습니다.
의사가 허락하지 않는 한, 어떤 종류의 감염이 있는 경우 STELARA 복용을 시작해서는 안 됩니다. STELARA를 시작하기 전에 다음 사항을 의사에게 알리십시오.
|
|||
|
|
||
STELARA 복용 시작 후 감염 증상(위 참조)이 나타나면 즉시 의사에게 연락하십시오. 이러한 증상은 심각한 합병증을 유발할 수 있는 폐 감염, 피부 감염 또는 대상포진과 같은 감염의 징후일 수 있습니다. STELARA는 감염에 걸릴 가능성을 높이거나 기존 감염을 악화시킬 수 있습니다. 인터루킨 12(IL-12)와 인터루킨 23(IL-23) 단백질을 전혀 생성하지 않는 유전적 문제가 있는 사람들은 특정 심각한 감염의 위험이 더 높습니다. 이러한 감염은 전신으로 퍼져 사망에 이를 수 있습니다. STELARA를 복용하는 사람들은 이러한 감염에 걸릴 가능성이 더 높을 수도 있습니다. 암.STELARA는 면역 체계의 활동을 감소시키고 특정 유형의 암 위험을 증가시킬 수 있습니다. 이전에 어떤 종류의 암이 있었는지 의사에게 알리십시오. STELARA를 투여받고 피부암 위험 요소가 있는 일부 사람들은 특정 유형의 피부암이 발생했습니다. STELARA 치료 중에 새로운 피부 병변이 발생하면 의사에게 알리십시오. 후방 가역성 뇌병증 증후군(PRES).PRES는 뇌에 영향을 미치고 사망을 초래할 수 있는 드문 질환입니다. PRES의 원인은 알려져 있지 않습니다. PRES가 조기에 발견되어 치료되면 대부분의 사람들은 회복됩니다. 다음을 포함한 새로운 또는 악화되는 의학적 문제가 있는 경우 즉시 의사에게 알리십시오. |
|||
|
|
||
| STELARA는 무엇입니까? STELARA는 다음을 치료하는 처방약입니다.
6세 미만 어린이에게 STELARA가 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|||
| 우스테키누맙 또는 STELARA의 성분에 알레르기가 있는 경우 STELARA를 복용하지 마십시오. STELARA의 성분에 대한 전체 목록은 본 의약품 설명서의 끝 부분을 참조하십시오. | |||
|
STELARA를 투여받기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의사에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의사에게 알리십시오. 복용하는 약을 알고 있어야 합니다. 새로운 약을 복용할 때 의사와 약사에게 보여줄 수 있도록 약 목록을 보관하십시오. |
|||
STELARA는 어떻게 사용해야 합니까?
STELARA 용량을 준비하고 주사하는 방법과 사용한 바늘과 주사기를 올바르게 버리는 방법에 대한 지침은 이 약물 안내서 끝에 있는 자세한 사용 지침을 참조하십시오. 주사기, 바늘 및 바이알은 절대 재사용해서는 안 됩니다. 고무 마개에 구멍이 뚫린 후에는 STELARA가 유해한 박테리아에 오염되어 재사용할 경우 감염을 일으킬 수 있습니다. 따라서 사용하지 않은 STELARA는 버리십시오. |
|||
|
STELARA 사용 중 피해야 할 사항은 무엇입니까? STELARA를 복용하는 동안 생백신을 접종받지 않아야 합니다. “STELARA를 투여받기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의사에게 알리십시오.“를 참조하십시오. |
|||
| STELARA의 가능한 부작용은 무엇입니까? STELARA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
|||
|
|
||
|
|||
| STELARA의 흔한 부작용은 다음과 같습니다: | |||
|
|
||
| 이것들은 STELARA의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다 (1-800-FDA-1088). Janssen Biotech, Inc.에도 부작용을 보고할 수 있습니다 (1-800 JANSSEN (1-800-526-7736)). |
|||
STELARA는 어떻게 보관해야 합니까?
필요한 경우, 개별 STELARA 프리필드 시린지는 최대 30일 동안 최대 30°C(86ºF)의 실온에서 원래 포장 상자에 보관하여 빛으로부터 보호할 수도 있습니다. 냉장고에서 처음 꺼낸 날짜를 상자에 제공된 공간에 기록하십시오. 시린지를 실온에 보관한 후에는 냉장고에 다시 넣지 마십시오. 실온 보관 후 30일 이내에 사용하지 않은 시린지는 버리십시오. 포장 상자 또는 프리필드 시린지에 표시된 유효기간이 지난 STELARA는 사용하지 마십시오. STELARA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||
| STELARA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방되기도 합니다. 처방받지 않은 질환에 STELARA를 사용하지 마십시오. 자신과 같은 증상이 있는 다른 사람에게 STELARA를 주지 마십시오. 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 STELARA에 대한 정보는 의사 또는 약사에게 문의할 수 있습니다. |
|||
| STELARA의 성분은 무엇입니까? 활성 성분: ustekinumab 피하 주사용 1회용 프리필드 시린지에는 L-히스티딘, L-히스티딘 일염산염 일수화물, 폴리소르베이트 80 및 수크로스가 포함되어 있습니다. 피하 주사용 1회용 바이알에는 L-히스티딘, L-히스티딘 염산염 일수화물, 폴리소르베이트 80 및 수크로스가 포함되어 있습니다. 정맥 주입용 1회용 바이알에는 EDTA 이나트륨염 이수화물, L-히스티딘, L-히스티딘 염산염 일수화물, L-메티오닌, 폴리소르베이트 80 및 수크로스가 포함되어 있습니다. 제조사: Janssen Biotech, Inc., Horsham, PA 19044, US 허가 번호 1864 © 2012, 2016, 2019 Janssen Pharmaceutical Companies 자세한 내용은 www.stelarainfo.com을 방문하거나 1-800-JANSSEN (1-800-526-7736)으로 전화하십시오. |
|||
사용 지침
사용법
STELARA (
스텔라
)
(우스테키누맙)
피하 주사용 주사액
프리필드 시린지를 사용한 STELARA 주사 방법
STELARA를 사용하기 전에 이 사용 설명서를 읽어보십시오. 의사 또는 간호사가 STELARA 주사를 올바르게 준비하고 투여하는 방법을 보여줄 것입니다.
본인이 스스로 주사할 수 없는 경우:
- 의사 또는 간호사에게 도움을 요청하거나,
- 의사 또는 간호사로부터 교육을 받은 사람에게 주사를 요청하십시오.
의사, 간호사 또는 의료 전문가가 STELARA 주사 방법을 보여주기 전에는 스스로 주사하려고 하지 마십시오.
중요 정보:
- 시작하기 전에, 상자를 확인하여 올바른 용량인지 확인하십시오. 의사가 처방한 대로 45mg 또는 90mg이 될 것입니다.
- 용량이 45mg인 경우 45mg 프리필드 시린지 하나를 받게 됩니다.
- 용량이 90mg인 경우 90mg 프리필드 시린지 하나 또는 45mg 프리필드 시린지 두 개를 받게 됩니다.
90mg 용량에 45mg 프리필드 시린지 두 개를 받은 경우, 바로 연달아 두 번 주사해야 합니다.
- 체중이 132파운드(약 60kg) 이상인 12세 이상의 건선 환자는 프리필드 시린지를 사용할 수 있습니다.
- 프리필드 시린지와 상자에 있는 유효 기간을 확인하십시오. 유효 기간이 지났거나 프리필드 시린지를 최대 30일 동안 최대 30ºC(86ºF)의 실온에 보관했거나 30ºC(86ºF) 이상의 온도에 보관한 경우 사용하지 마십시오. 유효 기간이 지났거나 프리필드 시린지를 30ºC(86ºF) 이상의 온도에 보관한 경우 의사 또는 약사에게 문의하거나 도움을 받기 위해 1-800-JANSSEN(1-800-526-7736)으로 전화하십시오.
- 시린지가 손상되지 않았는지 확인하십시오.
- 프리필드 시린지의 바늘 덮개에는 라텍스가 포함되어 있습니다. 라텍스 알레르기가 있는 경우 STELARA 프리필드 시린지의 바늘 덮개를 만지지 마십시오.
- 프리필드 시린지에 이물질이나 변색이 있는지 확인하십시오. 프리필드 시린지는 투명하고 무색에서 연한 노란색이며 흰색 입자가 거의 없어야 합니다.
- 동결되었거나 변색되었거나 탁하거나 큰 입자가 있는 경우 사용하지 마십시오. 새 프리필드 시린지를 구하십시오.
- 프리필드 시린지를 절대 흔들지 마십시오.프리필드 시린지를 흔들면 STELARA 약물이 손상될 수 있습니다. 프리필드 시린지를 흔든 경우 사용하지 마십시오. 새 프리필드 시린지를 구하십시오.
- 우발적인 바늘 찔림 위험을 줄이기 위해 각 프리필드 시린지에는 주사 후 바늘을 자동으로 덮는 바늘 보호대가 있습니다. 플런저를 절대 뒤로 당기지 마십시오.
주사를 준비하고 투여하는 데 필요한 물품을 준비하십시오. (
그림 A 참조)
다음이 필요합니다.
- 소독용 알코올 솜
- 솜뭉치 또는 거즈
- 반창고
- 처방된 용량의 STELARA
(
그림 B 참조)
- FDA 승인 일회용 주사기 폐기 용기.
”
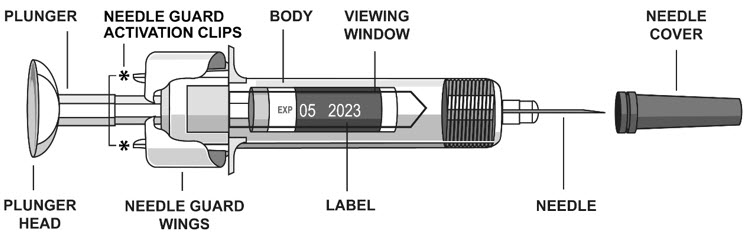
바늘 안전 보호대의 조기 작동을 방지하려면 사용 중에 언제든지 NEEDLE GUARD ACTIVATION CLIPS를 만지지 마십시오.
1단계: 주사 준비
- 조명이 잘 되고 깨끗하며 평평한 작업대를 선택하십시오.
- 비누와 미온수로 손을 잘 씻으십시오.
- 덮개가 씌워진 바늘이 위쪽을 향하도록 프리필드 시린지를 잡으십시오.
2단계: 주사 부위 준비
- 복부, 엉덩이, 허벅지(다리 위쪽) 주변의 주사 부위를 선택하십시오. 보호자가 주사하는 경우, 팔 위쪽의 바깥쪽 부위도 사용할 수 있습니다.
(
그림 C 참조)
- 각 주사마다 다른 주사 부위를 사용하십시오. 피부가 압통이 있거나 멍이 들거나 붉거나 단단한 부위에는 주사하지 마십시오.
- 주사할 부위의 피부를 소독용 알코올 솜으로 닦으십시오.
- 주사하기 전에 다시 이 부위를 만지지 마십시오.주사하기 전에 피부를 말리십시오.
- 닦은 부위에 바람을 불거나 부채질하지 마십시오.
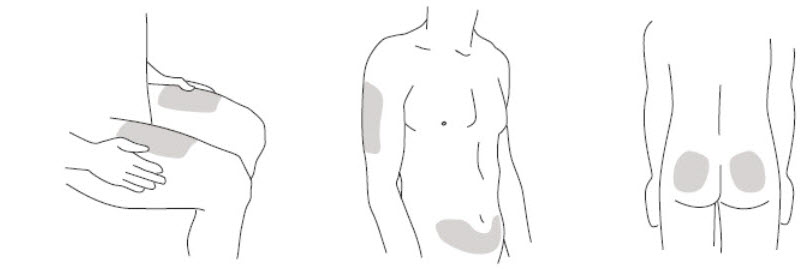
*회색으로 표시된 부위는 권장 주사 부위입니다.
3단계: STELARA 주사
- STELARA를 주사할 준비가 되면 바늘 덮개를 제거하십시오.
- 바늘 덮개를 제거하는 동안 플런저를 만지지 마십시오.
- 한 손으로 프리필드 시린지 본체를 잡고 바늘 덮개를 똑바로 잡아 당겨 제거하십시오.
(
그림 D 참조)
- 바늘 덮개를 쓰레기통에 버리십시오.
- 바늘 끝에 액체 한 방울이 보일 수도 있습니다. 이는 정상입니다.
- 바늘을 만지거나 다른 것에 닿게 하지 마십시오.
- 바늘 덮개가 없는 상태에서 프리필드 시린지가 떨어진 경우 사용하지 마십시오.지시 사항을 얻기 위해 의사, 간호사 또는 의료 전문가에게 문의하십시오.
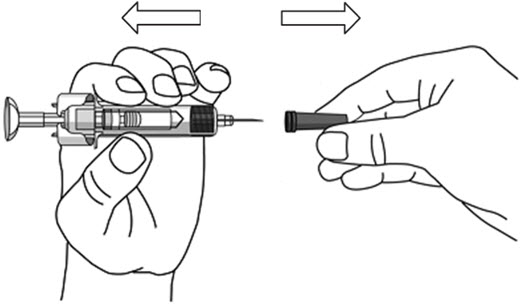
- 엄지와 집게손가락으로 한 손에 프리필드 시린지 본체를 잡으십시오.
(
그림 E 참조)
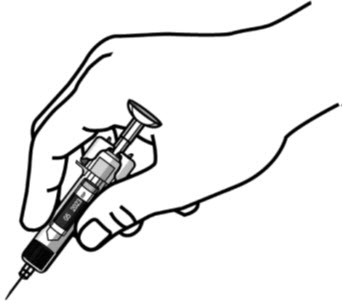
- 절대피스톤을 뒤로 당기지 마십시오.
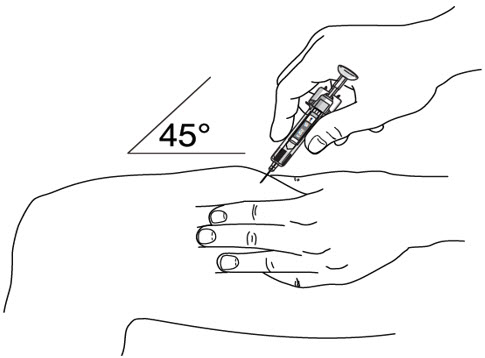
- 다른 손으로 깨끗하게 닦은 피부 부위를 살짝 집어서 단단히 잡습니다.
- 약 45도 각도로 집은 피부에 바늘을 재빨리 찔러 넣습니다.
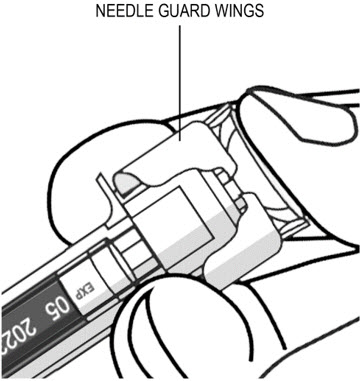
(
- 엄지손가락으로 피스톤을 밀어 피스톤 헤드가 바늘 보호대 날개 사이에 완전히 들어갈 때까지 모든 액체를 주입합니다.
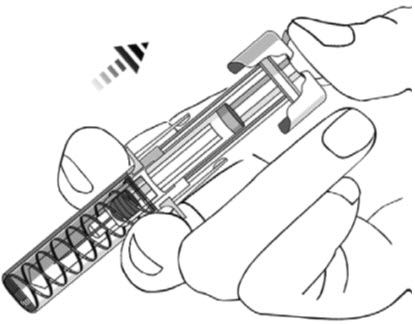
(
- 피스톤이 더 이상 밀리지 않을 때까지 피스톤 헤드에 압력을 가합니다. 바늘을 피부에서 빼고 피부를 놓습니다.
- 엄지손가락을 피스톤 헤드에서 천천히 뗍니다. 그러면 빈 주사기가 위로 이동하여 바늘 전체가 바늘 보호대에 완전히 덮입니다.
(
- 바늘을 피부에서 빼낼 때 주사 부위에 약간의 출혈이 있을 수 있습니다. 이는 정상적인 현상입니다. 필요한 경우 면봉이나 거즈 패드를 주사 부위에 눌러 줍니다. 주사 부위를 문지르지 마십시오. 필요한 경우 작은 접착식 붕대를 주사 부위에 붙일 수 있습니다.
투여량이 90mg인 경우 90mg 프리필드 시린지 1개 또는 45mg 프리필드 시린지 2개를 받게 됩니다. 90mg 투여량에 대해 45mg 프리필드 시린지 2개를 받는 경우 첫 번째 주사 직후에 두 번째 주사를 맞아야 합니다. 새로운 시린지를 사용하여 두 번째 주사에 대해 1~3단계를 반복합니다. 두 번째 주사는 다른 부위에 맞습니다.
- 사용 후 즉시 주사기를 FDA 승인 샤프스 폐기 용기에 버립니다.
가정 쓰레기에 주사기를 그냥 버리지 마십시오.
- FDA 승인 샤프스 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진 것
- 날카로운 물건이 빠져나올 수 없도록 꽉 끼는, 천공 방지 뚜껑으로 닫을 수 있는 것
- 사용 중에 똑바로 서고 안정적인 것
- 누출 방지 기능이 있는 것
- 용기 내 위험 폐기물을 경고하는 적절한 라벨이 붙어 있는 것
- 샤프스 폐기 용기가 거의 가득 차면 지역 사회의 지침에 따라 샤프스 폐기 용기를 올바르게 폐기해야 합니다. 주사기와 바늘을 버리는 방법에 대한 지역 또는 주 법률이 있을 수 있습니다. 안전한 샤프스 폐기에 대한 자세한 내용과 거주하는 주의 샤프스 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
- 지역 사회 지침에서 허용하지 않는 한 샤프스 폐기 용기를 가정 쓰레기에 버리지 마십시오. 샤프스 폐기 용기를 재활용하지 마십시오.
- 궁금한 점이 있으면 의사나 약사에게 문의하십시오.
STELARA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
프리필드 시린지 제조사:
Janssen Biotech, Inc., Horsham, PA 19044, 미국 허가 번호 1864, Baxter Pharmaceutical Solutions, Bloomington, IN 47403 및 Cilag AG, Schaffhausen, 스위스
본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2020년 3월
© 2012 Janssen Pharmaceutical Companies
사용 지침
사용법
STELARA (
스텔라
)
(우스테키누맙)
피하 주사용액
바이알에서 STELARA 주사하는 방법
STELARA를 사용하기 전에 이 사용 설명서를 읽어보십시오. 의사 또는 간호사가 STELARA를 준비하고, 용량을 측정하고, 올바르게 주사하는 방법을 보여줄 것입니다.
스스로 주사할 수 없는 경우:
- 의사 또는 간호사에게 도움을 요청하거나,
- 의사 또는 간호사로부터 훈련받은 사람에게 주사를 요청하십시오.
의사, 간호사 또는 의료 전문가가 STELARA 주사 방법을 보여주기 전에는 스스로 주사하려고 하지 마십시오.
중요 정보:
- 시작하기 전에, 상자를 확인하여 올바른 용량인지 확인하십시오. 의사가 처방한 대로 45mg 또는 90mg이 될 것입니다.
- 용량이 45mg 이하인 경우 45mg 바이알 하나를 받게 됩니다.
- 용량이 90mg인 경우 45mg 바이알 두 개를 받게 되며,
바로 연달아 두 번 주사해야 합니다.
- 체중이 60kg(132파운드) 미만인 12세 이상의 어린이는 45mg 미만의 용량이 필요합니다.
- 바이알과 상자에 있는 유효 기간을 확인하십시오. 유효 기간이 지난 경우 사용하지 마십시오. 유효 기간이 지난 경우 의사 또는 약사에게 문의하거나, 도움을 받으려면 1-800-JANSSEN(1-800-526-7736)으로 전화하십시오.
- 바이알에 입자나 변색이 있는지 확인하십시오. 바이알은 투명하고 무색에서 연한 노란색이며 흰색 입자가 거의 없어야 합니다.
- 얼거나 변색되거나 탁하거나 큰 입자가 있는 경우 사용하지 마십시오. 새 바이알을 구하십시오.
- 바이알을 절대 흔들지 마십시오.바이알을 흔들면 STELARA 약물이 손상될 수 있습니다. 바이알을 흔든 경우 사용하지 마십시오. 새 바이알을 구하십시오.
- 바이알에 약물이 남아 있더라도 STELARA 바이알을 한 번 이상 사용하지 마십시오. 고무 마개에 구멍이 뚫린 후에는 STELARA가 유해한 박테리아에 오염되어 재사용할 경우 감염을 일으킬 수 있습니다. 따라서 주사 후 사용하지 않은 STELARA는 버리십시오.
- 사용 후 STELARA 바이알을 안전하게 버리십시오.
- 주사기나 바늘을 재사용하지 마십시오. ”
를 참조하십시오.
- 바늘에 찔리는 것을 방지하기 위해,
절대바늘을 다시 덮지 마십시오.
STELARA를 준비하고 주사하는 데 필요한 물품을 준비하십시오. (
참조)
다음이 필요합니다.
- 바늘이 부착된 주사기(약국에서 바늘이 부착된 주사기를 받으려면 의료 제공자의 처방전이 필요합니다).
- 소독용 알코올 솜
- 면봉 또는 거즈
- 반창고
- 처방받은 용량의 STELARA
- FDA 승인 일회용 바늘 처리 용기. ”
를 참조하십시오.
그림 A
1단계: 주사 준비.
- 조명이 잘 되고 깨끗하며 평평한 작업대를 선택하십시오.
- 비누와 미온수로 손을 잘 씻으십시오.
2단계: 주사 부위 준비
- 복부, 엉덩이 및 허벅지 주변의 주사 부위를 선택하십시오.
보호자가 주사하는 경우, 팔의 바깥쪽 부위도 사용할 수 있습니다.(
참조)
- 각 주사마다 다른 주사 부위를 사용하십시오. 피부가 아프거나, 멍이 들거나, 붉거나, 단단한 부위에는 주사하지 마십시오.
- 주사할 부위의 피부를 소독용 알코올 솜으로 닦으십시오.
- 절대주사하기 전에 이 부위를 다시 만지지 마십시오. 주사하기 전에 피부를 말리십시오.
- 절대깨끗한 부위에 바람을 불거나 부채질하지 마십시오.
그림 B
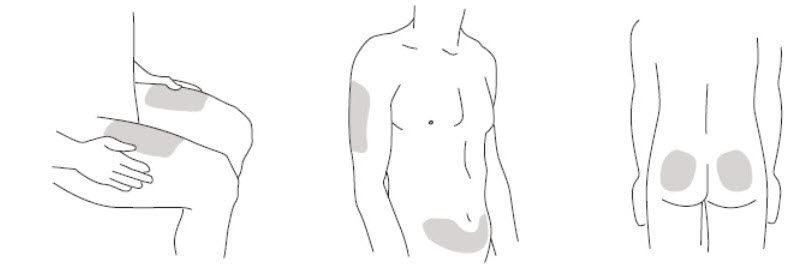
*회색으로 표시된 부위는 권장 주사 부위입니다.
3단계: 바이알 준비.
- 바이알 상단의 캡을 제거하십시오. 캡은 버리지만 고무 마개는 제거하지 마십시오.
(
참조)
그림 C

- 소독용 면봉으로 고무 마개를 닦으십시오.
(
참조)
그림 D
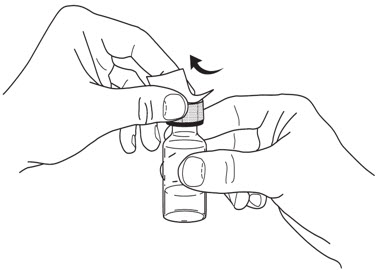
- 닦은 후에는 고무 마개를 만지지 마십시오.
- 바이알을 평평한 표면에 놓으십시오.
4단계: 바늘 준비
- 바늘이 부착된 주사기를 집으십시오.
- 바늘을 덮고 있는 캡을 제거하십시오.
(
참조)
- 바늘 캡을 버리십시오. 바늘을 만지거나 다른 것에 닿게 하지 마십시오.
그림 E
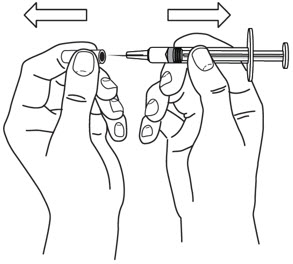
- 의사가 처방한 용량에 맞는 선까지 플런저를 조심스럽게 당기십시오.
- 엄지와 집게손가락으로 바이알을 잡으십시오.
- 다른 손으로 주사기 바늘을 고무 마개 중앙에 밀어넣으십시오.
(
참조)
그림 F
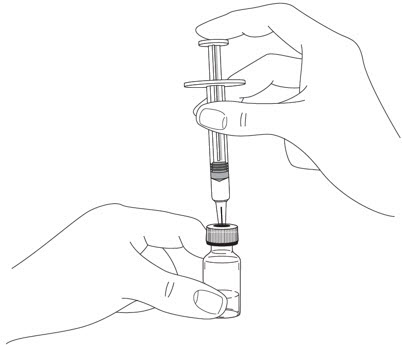
- 플런저를 눌러 주사기 내의 공기가 모두 바이알로 들어가도록 합니다.
- 바이알과 주사기를 뒤집습니다.
(그림 G 참조
그림 G)
- 한 손으로 STELARA 바이알을 잡습니다.
- 주사기 내에 기포가 생기는 것을 방지하기 위해 바늘이 항상 액체 속에 있어야 합니다.
- 다른 손으로 주사기 플런저를 뒤로 당깁니다.
- 플런저의 검은색 끝이 처방된 용량에 해당하는 표시와 일치할 때까지 주사기를 채웁니다.
그림 G
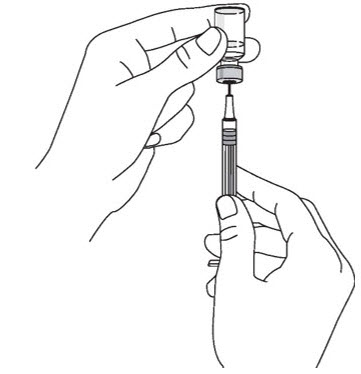
- 바늘을 바이알에서 제거하지 마십시오.바늘이 위쪽을 향하도록 주사기를 잡고 내부에 기포가 있는지 확인합니다.
- 기포가 있는 경우 주사기 옆면을 가볍게 두드려 기포가 위로 올라오도록 합니다.
(그림 H 참조
그림 H)
- 플런저를 천천히 눌러 주사기 내의 기포를 모두 제거합니다(액체는 나오지 않도록 주의).
- 주사기를 바이알에서 제거합니다. 주사기를 놓거나 바늘이 다른 물체에 닿지 않도록 합니다.
그림 H
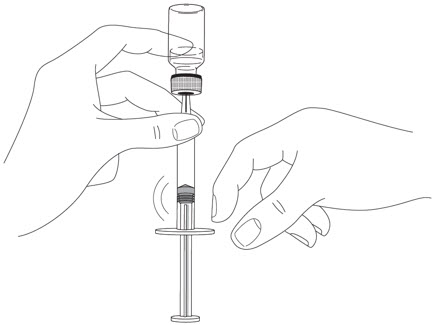
5단계: STELARA 주사
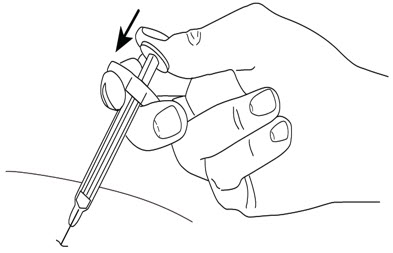
- 한 손으로 주사기 본체를 엄지와 검지 사이에 잡습니다.
- 절대플런저를 뒤로 당기지 마십시오.
- 다른 손으로 소독한 피부 부위를 살짝 집어 단단히 잡습니다.
- 약 45도 각도로 집은 피부에 바늘을 빠르게 찔러 넣습니다.
(그림 I 참조
그림 I)
그림 I
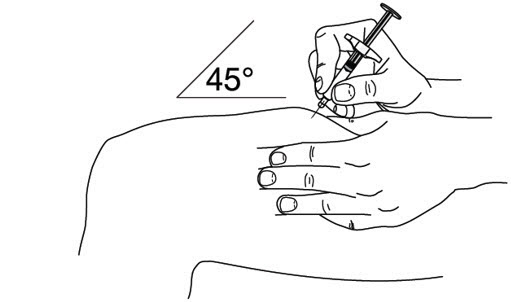
- 엄지로 플런저를 끝까지 밀어 액체를 모두 주사합니다. 피부를 살짝 집은 상태로 천천히 그리고 고르게 밀어줍니다.
- 주사기가 비면 피부에서 바늘을 빼고 피부를 놓습니다.
(그림 J 참조
그림 J)
그림 J
- 바늘을 피부에서 빼면 주사 부위에 약간의 출혈이 있을 수 있습니다. 이는 정상적인 현상입니다. 필요한 경우 면봉이나 거즈로 주사 부위를 눌러줍니다. 주사 부위를 문지르지 마십시오. 필요한 경우 작은 반창고로 주사 부위를 덮을 수 있습니다.
용량이 90mg인 경우 45mg 바이알 두 개를 받게 되며 첫 번째 주사 직후 두 번째 주사를 맞아야 합니다. 새로운 주사기를 사용하여 1~5단계를 반복합니다.두 번째 주사는 다른 부위를 선택하십시오.
6단계: 바늘과 주사기 폐기
- 절대주사기나 바늘을 재사용하지 마십시오.
- 바늘에 찔리는 것을 방지하기 위해 바늘을 다시 덮지 마십시오.
- 사용 후 바로 FDA 승인 샤프스 폐기 용기에 바늘과 주사기를 버립니다.
주택 쓰레기에 바늘과 주사기를 따로 버리지 마십시오.
- FDA 승인 샤프스 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 제작된 경우
- 샤프스가 빠져나올 수 없도록 꽉 끼는, 천공 방지 뚜껑으로 닫을 수 있는 경우
- 사용 중에도 똑바로 서고 안정적인 경우
- 누출 방지 기능이 있는 경우
- 용기 내부의 위험 폐기물을 경고하는 적절한 라벨이 부착된 경우
- 샤프스 폐기 용기가 거의 가득 차면 지역 사회의 샤프스 폐기 지침에 따라 폐기해야 합니다. 주사기와 바늘을 버리는 방법에 대한 지역 또는 주 법률이 있을 수 있습니다. 안전한 샤프스 폐기에 대한 자세한 내용과 거주 주의 샤프스 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
- 지역 사회의 지침에서 허용하지 않는 한 샤프스 폐기 용기를 가정 쓰레기에 버리지 마십시오. 샤프스 폐기 용기를 재활용하지 마십시오.
- 주사기와 바늘을 버리는 용기에 바이알을 버립니다.
- 궁금한 점이 있으면 의사나 약사에게 문의하십시오.
STELARA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
바이알 제조사: Janssen Biotech, Inc., Horsham, PA 19044, 미국 허가 번호 1864, Cilag AG, Schaffhausen, 스위스
본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2020년 3월
© 2012, 2016 Janssen Pharmaceutical Companies
주요 표시 패널 – 45mg/0.5mL 바이알 카톤
스텔라라®
(우스테키누맙)
주사제
45 mg/0.5 mL
피하 주사용
45 mg/0.5 mL 프리필드 시린지 1개 함유
NDC 57894-060-03
1회용 프리필드 시린지 – 사용하지 않은 부분은 버리십시오
45 mg 프리필드 시린지에는 다음 성분이 함유되어 있습니다:
우스테키누맙 45 mg, L-히스티딘 및 L-히스티딘
일수화물 0.5 mg, 폴리소르베이트 80 0.02 mg,
수크로스 38 mg (총 용량 0.5 mL)
투여 정보는 패키지 삽입물을 참조하십시오
처방전 의약품
주의: 동봉된 약물 안내서를
각 환자에게 제공하십시오.
© 2009 Janssen

주요 표시 패널 – 90mg/mL 시린지 카톤
스텔라라®
(우스테키누맙)
주사제
90 mg/mL
피하 주사용
90 mg/mL 프리필드 시린지 1개 함유
NDC 57894-061-03
1회용 프리필드 시린지 – 사용하지 않은 부분은 버리십시오
90 mg 프리필드 시린지 함량:
우스테키누맙 90 mg, L-히스티딘 및 L-히스티딘
일수화염산염 일수화물 1 mg, 폴리소르베이트 80 0.04 mg,
수크로스 76 mg (최종 부피 1 mL)
투여 정보는 패키지 삽입물을 참조하십시오
처방전 의약품
주의: 동봉된 약물 사용 설명서를
각 환자에게 제공하십시오.
© 2009 Janssen
주요 표시 패널 – 130mg/26mL 바이알 카톤
NDC 57894-054-27
1회용 바이알
사용하지 않은 부분은 버리십시오
스텔라라®
(우스테키누맙)
주사제
130 mg/26 mL
(5 mg/mL)
정맥 주입 전용
희석해야 함
주의: 동봉된 약물 사용 설명서를 각 환자에게 제공하십시오.
처방전 의약품
얀센


