의약품 제조업체: Ascend Laboratories, LLC (Updated: 2024-07-03)
처방 정보의 주요 내용
EVEROLIMUS tablets, 경구 투여용
미국 최초 승인: 2010
경고: 악성 종양 및 심각한 감염; 신장 이식편 혈전증; 신독성; 심장 이식에서의 사망률
전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.
• 면역억제 요법 및 이식 환자 관리에 경험이 있는 의사만이 에베롤리무스 정제를 사용해야 합니다 (5.1)
• 면역억제는 감염에 대한 감수성 증가 및 악성 종양 발생 가능성을 초래할 수 있습니다 (5.2, 5.3)
• 신장 이식편 혈전증 발생률 증가 (5.4)
• 신독성을 줄이기 위해 에베롤리무스 정제와 병용하여 사용하는 경우 사이클로스포린 용량을 줄여야 합니다 (2.4, 2.5, 5.6, 12.7, 12.8)
• 심장 이식 임상 시험에서 사망률 증가. 심장 이식에서의 사용은 권장되지 않습니다 (5.7)
최근 주요 변경 사항
경고 및 주의 사항, 칸나비디올 약물 상호 작용 (5.22) 9/2023
적응증 및 사용
에베롤리무스 정제는 성인 환자에서 장기 거부 반응 예방을 위한 mTOR 억제제 면역억제제입니다.
• 신장 이식: 낮은-중간 면역학적 위험. 바실릭시맙, 사이클로스포린(감소된 용량) 및 코르티코스테로이드와 병용하여 사용 (1.1)
• 간 이식: 이식 후 30일 이전에 투여하지 마십시오. 타크로리무스(감소된 용량) 및 코르티코스테로이드와 병용하여 사용 (1.2, 5.5)
사용 제한:
다음과 같은 경우 안전성 및 효능이 확립되지 않았습니다.
• 높은 면역학적 위험이 있는 신장 이식 환자 (1.3)
• 신장 또는 간 이외의 이식된 장기를 받은 수혜자 (1.3, 5.7)
• 소아 환자(18세 미만) (1.3)
투여량 및 투여 방법
• 신장 이식: 이식 후 가능한 한 빨리 1일 2회 0.75mg의 경구 시작 용량 (2.1)
• 간 이식: 이식 후 30일부터 1일 2회 1mg의 경구 시작 용량 (2.2)
• 에베롤리무스 농도 모니터링: LC/MS/MS 분석법을 사용하여 3~8ng/mL 목표 범위 내의 골 농도를 달성하도록 유지 용량 조정 (2.1, 2.2, 2.3)
• 사이클로스포린 또는 타크로리무스와 동시에 음식과 함께 또는 음식 없이 일관되게 투여 (2.6, 12.3)
• 경미한 간 기능 장애: 초기 일일 용량을 1/3 감소 (2.7)
• 중등도 또는 중증 간 기능 장애: 초기 일일 용량을 1/2 감소 (2.7, 12.6)
투여 형태 및 강도
에베롤리무스 정제는 0.25mg, 0.5mg, 0.75mg 및 1mg 정제로 제공됩니다. (3)
금기 사항
• 에베롤리무스, 시롤리무스 또는 약물 제제 성분에 대한 과민증 (4)
처방 정보 주요 사항
• 안지오에데마 [안지오텐신 전환 효소 (ACE) 억제제와 병용 시 위험 증가]: 증상을 모니터링하고 즉시 치료하십시오 (5.8)
• 지연된 상처 치유/체액 축적: 증상을 모니터링하고 합병증을 최소화하기 위해 즉시 치료하십시오 (5.9)
• 간질성 폐 질환 (ILD)/비감염성 폐렴: 증상 또는 방사선학적 변화를 모니터링하십시오. 증상이 해결될 때까지 용량 감소 또는 중단으로 관리하십시오. 코르티코스테로이드 사용을 고려하십시오 (5.10)
• 고지혈증 (혈청 콜레스테롤 및 트리글리세리드 상승): 모니터링하고 항지질 요법을 고려하십시오 (5.11)
• 단백뇨 (최저 농도가 높을수록 위험 증가): 요 단백질을 모니터링하십시오 (5.12)
• 폴리오마 바이러스 감염 (잠복 바이러스 감염 활성화; BK 바이러스 관련 신증): 면역 억제를 줄이는 것을 고려하십시오 (5.13)
• TMA/TTP/HUS (시클로스포린과 병용 시 위험 증가): 혈액학적 변화 또는 증상을 모니터링하십시오 (5.15)
• 이식 후 신규 발병 당뇨병: 혈당을 모니터링하십시오 (5.16)
• 남성 불임: 무정자증 또는 희소정자증이 발생할 수 있습니다 (5.18, 13.1)
• 예방 접종: 생백신을 피하십시오 (5.19)
• 태아 독성: 생식 가능 연령의 여성에게 태아에 대한 잠재적 위험을 알리고 에베롤리무스 치료 중 및 최종 투여 후 8주 동안 효과적인 피임법을 사용하도록 조언하십시오 (5.17, 8.1, 8.3)
부작용
가장 흔한 부작용은 다음과 같습니다.
- 신장 이식 (발생률 20% 이상): 말초 부종, 변비, 고혈압, 메스꺼움, 빈혈, 요로 감염 (UTI), 및 고지혈증 (6.1)
- 간 이식 (발생률 10% 이상): 설사, 두통, 말초 부종, 고혈압, 메스꺼움, 발열, 복통, 백혈구 감소증, 고콜레스테롤혈증 (6.1)
의심되는 부작용을 보고하려면 Ascend Laboratories, LLC에 1-877-272-7901로 연락하거나 FDA에 1-800-FDA-1088로 연락하십시오 (www.fda.gov/medwatch).
약물 상호 작용
특정 인구 집단에서의 사용
환자 상담 정보는 17을 참조하십시오.
개정: 2024년 3월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
경고: 악성 종양 및 심각한 감염; 신장 이식 거부 반응; 신독성; 심장 이식 시 사망
1 적응증 및 용법
1.1 신장 이식에서의 장기 거부 반응 예방
1.2 간 이식에서의 장기 거부 반응 예방
1.3 사용 제한
2 용량 및 투여
2.1 성인 신장 이식 환자의 용량
2.2 성인 간 이식 환자의 용량
2.3 치료 약물 모니터링(TDM) – 에베로리무스
2.4 치료 약물 모니터링(TDM) – 신장 이식 환자의 사이클로스포린
2.5 치료 약물 모니터링(TDM) – 간 이식 환자의 타크롤리무스
2.6 투여
2.7 간 장애
3 투여 형태 및 용량
4 금기 사항
4.1 과민 반응
5 경고 및 주의 사항
5.1 면역 억제 관리
5.2 림프종 및 기타 악성 종양
5.3 심각한 감염
5.4 신장 이식 혈전증
5.5 간동맥 혈전증
5.6 에베로리무스 및 칼시뉴린 억제제 유발 신독성
5.7 심장 이식
5.8 혈관 부종
5.9 상처 치유 및 체액 축적
5.10 간질성 폐 질환(ILD)/비감염성 폐렴
5.11 고지혈증
5.12 단백뇨
5.13 폴리오마 바이러스 감염
5.14 CYP3A4의 강력한 억제제 및 유도제와의 상호 작용
5.15 혈전성 미세혈관병증/혈전성 혈소판 감소성 자반증/용혈성 요독 증후군
5.16 이식 후 새롭게 발생하는 당뇨병
5.17 배아-태아 독성
5.18 남성 불임
5.19 예방 접종
5.20 자몽 주스와의 상호 작용
5.21 유전 질환/기타 환자
5.22 칸나비디올 약물 상호 작용
6 이상 반응
6.1 심각하고 중요한 이상 반응
6.2 임상 시험 경험
6.3 시판 후 경험
7 약물 상호 작용
7.1 CYP3A4 및 P-당단백질의 강력한 억제제 또는 유도제와의 상호 작용
7.2 사이클로스포린(CYP3A4/P-gp 억제제 및 CYP3A4 기질)
7.3 케토코나졸 및 기타 강력한 CYP3A4 억제제
7.4 에리스로마이신(중간 CYP3A4 억제제)
7.5 베라파밀(CYP3A4 및 P-gp 기질)
7.6 아토르바스타틴(CYP3A4 기질) 및 프라바스타틴(P-gp 기질)
7.7 심바스타틴 및 로바스타틴
7.8 리팜핀(강력한 CYP3A4/P-gp 유도제)
7.9 미다졸람(CYP3A4/5 기질)
7.10 기타 가능한 상호 작용
7.11 옥트레오타이드
7.12 타크롤리무스
7.13 칸나비디올
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아용
8.5 노인용
8.6 간 장애
8.7 신장 장애
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.3 약동학
12.5 약물-약물 상호 작용
12.6 특정 집단
12.7 신장 및 간 이식 환자에서 관찰된 에베로리무스 전혈 농도
12.8 신장 이식 환자에서 관찰된 사이클로스포린 농도
12.9 간 이식에서의 타크롤리무스 농도
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 장애
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 신장 이식 후 장기 거부 반응 예방
14.2 간 이식 후 장기 거부 반응 예방
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
블랙박스 경고
경고: 악성 종양 및 심각한 감염; 신장 이식편 혈전증; 신독성; 및 심장 이식에서의 사망률
악성 종양 및 심각한 감염
• 면역 억제 요법 및 이식 환자 관리에 경험이 있는 의사만이 에베롤리무스 정을 처방해야 합니다. 이 약을 투여받는 환자는 적절한 실험실 및 지원 의료 자원을 갖추고 직원이 있는 시설에서 관리해야 합니다. 유지 요법을 담당하는 의사는 환자 추적에 필요한 모든 정보를 갖추어야 합니다 [경고 및 주의 사항 (5.1) 참조].
• 면역 억제로 인해 감염에 대한 감수성이 증가하고 림프종 및 피부암과 같은 악성 종양이 발생할 수 있습니다 [경고 및 주의 사항 (5.2, 5.3) 참조].
신장 이식편 혈전증
• 이식 후 첫 30일 이내에 주로 발생하는 신장 동맥 및 정맥 혈전증의 위험이 증가하여 이식편 손실이 보고되었습니다 [경고 및 주의 사항 (5.4) 참조].
신독성
• 에베롤리무스 정과 함께 표준 용량의 시클로스포린을 사용하면 신독성이 증가할 수 있습니다. 따라서 신장 기능 장애를 줄이기 위해 에베롤리무스 정과 함께 시클로스포린 용량을 줄여야 합니다. 시클로스포린 및 에베롤리무스 정 전혈 혈중 농도를 모니터링하는 것이 중요합니다s [용법 및 용량 (2.4, 2.5), 경고 및 주의 사항 (5.6), 임상 약리 (12.7, 12.8) 참조].
심장 이식에서의 사망률
• 유도 요법 유무에 관계없이 면역 억제 요법을 받는 신규 심장 이식 환자를 대상으로 한 임상 시험에서 이식 후 첫 3개월 이내에 심각한 감염과 관련된 사망률이 증가했습니다. 심장 이식에서의 사용은 권장되지 않습니다 [경고 및 주의 사항 (5.7) 참조].
1 적응증 및 용법
1.1 신장 이식 거부 반응 예방
에베롤리무스 정제는 신장 이식을 받은 낮은 면역 위험 또는 중간 면역 위험의 성인 환자에서 장기 거부 반응 예방에 사용됩니다 [임상 연구 (14.1) 참조]. 에베롤리무스 정제는 바실릭시맙 유도 요법과 함께, 사이클로스포린 감량과 함께, 그리고 코르티코스테로이드와 함께 투여해야 합니다. 에베롤리무스 정제와 사이클로스포린의 치료 약물 모니터링(TDM)은 이러한 제품을 투여받는 모든 환자에게 권장됩니다 [투여 및 투약 (2.2, 2.3) 참조].
1.2 간 이식 거부 반응 예방
에베롤리무스 정제는 간 이식을 받은 성인 환자에서 이식편 거부 반응 예방에 사용됩니다. 에베롤리무스 정제는 이식 후 30일 이후에 타크로리무스 감량과 함께, 그리고 코르티코스테로이드와 함께 투여해야 합니다 [경고 및 주의 사항 (5.5), 임상 연구 (14.2) 참조]. 에베롤리무스 정제와 타크로리무스의 TDM은 이러한 제품을 투여받는 모든 환자에게 권장됩니다 [투여 및 투약 (2.3, 2.5) 참조].
1.3 사용 제한
에베롤리무스 정제의 안전성 및 유효성은 다음과 같은 환자군에서 확립되지 않았습니다.
• 높은 면역 위험의 신장 이식 환자.
• 신장 및 간 이외의 장기를 이식받은 환자 [경고 및 주의 사항 (5.7) 참조].
• 소아 환자(18세 미만).
2. 용법용량
에베롤리무스 정제를 투여받는 환자는 에베롤리무스 정제 혈중 농도, 내약성, 개별 반응, 동반 약물 변경 및 임상 상황에 따라 용량 조절이 필요할 수 있습니다. 이상적으로 에베롤리무스 정제의 용량 조절은 이전 용량 변경 후 4일 또는 5일째에 얻은 최저 농도를 기반으로 해야 합니다. 최저 농도가 3 ng/mL 미만인 경우 용량 조절이 필요합니다. 에베롤리무스 정제의 총 일일 용량은 사용 가능한 정제 강도(0.25 mg, 0.5 mg, 0.75 mg 또는 1 mg)를 사용하여 2배로 늘려야 합니다. 최저 농도가 2회 연속 측정에서 8 ng/mL를 초과하는 경우에도 용량 조절이 필요합니다. 에베롤리무스 정제의 용량은 하루 2회 0.25 mg 감소해야 합니다 [용량 및 투여( 2.3), 임상 약리( 12.3) 참조].
2.1 성인 신장 이식 환자의 용량
성인 신장 이식 환자의 경우 이식 후 가능한 한 빨리 감소된 용량의 시클로스포린과 함께 경구로 하루 2회 0.75 mg(하루 1.5 mg)의 에베롤리무스 정제 초기 용량을 투여하는 것이 좋습니다 [용량 및 투여( 2.3, 2.4), 임상 연구( 14.1) 참조].
경구 약물을 견딜 수 있게 되면 경구 프레드니손을 시작해야 합니다. 환자의 임상 상태와 이식편 기능에 따라 스테로이드 용량은 개별적으로 추가로 감소시킬 수 있습니다.
2.2 성인 간 이식 환자의 용량
이식 후 최소 30일 후에 에베롤리무스 정제를 시작하십시오. 성인 간 이식 환자의 경우 감소된 용량의 타크로리무스와 함께 경구로 하루 2회 1 mg(하루 2 mg)의 초기 용량을 투여하는 것이 좋습니다 [용량 및 투여( 2.3, 2.5), 임상 연구( 14.2) 참조].
환자의 임상 상태와 이식편 기능에 따라 스테로이드 용량은 개별적으로 추가로 감소시킬 수 있습니다.
2.3 치료 약물 모니터링(TDM) – 에베롤리무스
모든 환자에게 에베롤리무스 전혈 치료 약물 농도 모니터링을 정기적으로 수행하는 것이 좋습니다. 권장되는 에베롤리무스 치료 범위는 3~8 ng/mL입니다 [임상 약리( 12.7) 참조]. 임상 징후 및 증상, 조직 생검 및 실험실 매개변수에 주의해야 합니다. 간 기능 장애가 있는 환자, CYP3A4 유도제 또는 억제제 또는 칸나비디올을 동시 투여하는 경우, 시클로스포린 제제를 전환하는 경우 및/또는 권장 목표 농도에 따라 시클로스포린 용량을 감소시키는 경우 에베롤리무스 혈중 농도를 모니터링하는 것이 중요합니다 [약물 상호 작용( 7), 임상 약리( 12.7, 12.8) 참조].
시클로스포린은 에베롤리무스에 대한 상호 작용이 있으며, 따라서 시클로스포린 노출이 감소하면 에베롤리무스 농도가 감소할 수 있습니다. 타크로리무스는 에베롤리무스에 대한 약물 동태적 상호 작용이 거의 없거나 전혀 없으므로 타크로리무스 노출이 감소해도 에베롤리무스 농도가 감소하지 않습니다 [약물 상호 작용( 7.2) 참조].
에베롤리무스의 권장되는 치료 범위인 3~8 ng/mL는 LC/MS/MS 분석 방법을 기반으로 합니다. 현재 임상 실무에서 에베롤리무스 전혈 최저 농도는 크로마토그래피 또는 면역 분석 방법으로 측정할 수 있습니다. 측정된 에베롤리무스 전혈 최저 농도는 사용된 분석법에 따라 다르므로 서로 다른 분석법에서 얻은 개별 환자 샘플 농도 값은 교환할 수 없습니다. 분석 결과를 고려할 때는 사용된 특정 분석법을 알고 있어야 합니다. 따라서 분석을 수행하는 실험실과 소통해야 합니다.
2.4 치료적 약물 모니터링(TDM) – 신장 이식 환자의 사이클로스포린
사이클로스포린 용량과 전혈 혈중 농도 목표 범위는 에베롤리무스 정제와 함께 투여할 때 신독성 위험을 최소화하기 위해 감소시켜야 합니다. [경고 및 주의 사항 (5.6), 약물 상호 작용 (7.2), 임상 약리학 (12.8) 참조].
에베롤리무스 정제와 함께 투여할 때 권장되는 사이클로스포린 치료 범위는 이식 후 1개월까지 전혈 혈중 농도 100~200 ng/mL, 이식 후 2~3개월은 75~150 ng/mL, 이식 후 4개월은 50~100 ng/mL, 이식 후 6개월부터 12개월까지는 25~50 ng/mL입니다. 임상 시험에서 관찰된 중간 혈중 농도는 이식 후 1개월까지 161~185 ng/mL, 이식 후 2~3개월은 111~140 ng/mL였습니다. 이식 후 4개월의 중간 혈중 농도는 99 ng/mL였으며, 이식 후 6개월부터 12개월까지는 46~75 ng/mL였습니다. [임상 약리학 (12.8), 임상 연구 (14.1) 참조].
사이클로스포린, USP 개량형은 사이클로스포린 경구 용액 또는 사이클로스포린 정맥 주사를 피할 수 없는 경우를 제외하고 하루 두 번 경구 캡슐로 투여해야 합니다. 사이클로스포린, USP 개량형은 이식편 재관류 후 가능한 한 빨리, 늦어도 재관류 후 48시간 이내에 시작해야 하며, 5일째부터 목표 농도에 맞춰 용량을 조절해야 합니다.
신장 기능 장애가 진행되면 치료 요법을 조정해야 합니다. 신장 이식 환자의 경우 사이클로스포린 용량은 사이클로스포린 전혈 혈중 농도를 기준으로 해야 합니다. [임상 약리학 (12.8) 참조].
신장 이식의 경우 12개월 후 사이클로스포린 혈중 농도를 25~50 ng/mL로 감소시킨 상태에서 에베롤리무스 정제 용량에 대한 데이터가 제한적입니다. 에베롤리무스 정제는 사이클로스포린의 다른 제형과 함께 임상 시험에서 평가되지 않았습니다. 사이클로스포린 용량을 감소시키기 전에 에베롤리무스 정제의 안정 상태 전혈 혈중 농도가 3 ng/mL 이상인지 확인해야 합니다. 사이클로스포린은 에베롤리무스에 영향을 미치므로 사이클로스포린 노출이 감소하면 에베롤리무스 농도가 감소할 수 있습니다. [약물 상호 작용 (7.2) 참조].
2.5 치료적 약물 모니터링(TDM) – 간 이식 환자의 타크로리무스
타크로리무스 용량과 전혈 혈중 농도 목표 범위는 에베롤리무스 정제와 함께 투여할 때 신독성 위험을 최소화하기 위해 감소시켜야 합니다. [경고 및 주의 사항 (5.6), 임상 약리학 (12.9) 참조].
에베롤리무스 정제와 함께 투여할 때 권장되는 타크로리무스 치료 범위는 에베롤리무스 정제 첫 번째 용량 투여 후 3주(약 2개월)부터 이식 후 12개월까지 전혈 혈중 농도(C-0h) 3~5 ng/mL입니다.
임상 시험에서 관찰된 타크로리무스 중간 혈중 농도는 이식 후 2주와 4주(에베롤리무스 투여 시작 전)에 8.6~9.5 ng/mL였습니다. 이식 후 5주와 6주에 타크로리무스 중간 혈중 농도는 7~8.1 ng/mL, 2개월과 3개월에 5.2~5.6 ng/mL, 4개월부터 12개월까지는 4.3~4.9 ng/mL였습니다. [임상 약리학 (12.9), 임상 연구 (14.2) 참조].
타크로리무스는 타크로리무스 정맥 주사를 피할 수 없는 경우를 제외하고 하루 두 번 경구 캡슐로 투여해야 합니다.
간 이식 환자의 경우 타크로리무스 용량은 타크로리무스 전혈 혈중 농도를 기준으로 해야 합니다. [임상 약리학 (12.9) 참조].
간 이식의 경우 12개월 후 타크로리무스 혈중 농도를 3~5 ng/mL로 감소시킨 상태에서 에베롤리무스 정제 용량에 대한 데이터가 제한적입니다. 타크로리무스 용량을 감소시키기 전에 에베롤리무스 정제의 안정 상태 전혈 혈중 농도가 3 ng/mL 이상인지 확인해야 합니다. 사이클로스포린과 에베롤리무스 간의 상호 작용과 달리 타크로리무스는 에베롤리무스 혈중 농도에 영향을 미치지 않으므로 타크로리무스 노출이 감소해도 에베롤리무스 농도는 감소하지 않습니다.
2.6 투여
에베롤리무스 정제는 물 한 잔과 함께 통째로 삼켜야 하며, 사용 전에 부수면 안 됩니다.
에베롤리무스 정제는 흡수 변동성을 최소화하기 위해 음식과 관계없이 약 12시간 간격으로 규칙적으로 투여해야 하며, 사이클로스포린 또는 타크로리무스와 동시에 투여해야 합니다. [임상 약리학 (12.3) 참조].
2.7 간 기능 장애
간 기능 장애 환자의 경우 에베롤리무스 전혈 혈중 농도를 면밀히 모니터링해야 합니다. 경증 간 기능 장애(Child-Pugh Class A) 환자의 경우 초기 일일 용량은 일반적으로 권장되는 일일 용량의 약 1/3으로 감소시켜야 합니다. 중등도 또는 중증 간 기능 장애(Child-Pugh Class B 또는 C) 환자의 경우 초기 일일 용량은 일반적으로 권장되는 일일 용량의 약 1/2로 감소시켜야 합니다. LC/MS/MS 분석법으로 측정한 에베롤리무스 전혈 혈중 농도가 3~8 ng/mL의 목표 혈중 농도 범위 내에 있지 않으면 추가 용량 조정 및/또는 용량 적정을 해야 합니다. [임상 약리학 (12.6) 참조].
3. 투여 형태 및 용량
Everolimus tablets 는 0.25 mg, 0.5 mg, 0.75 mg 및 1 mg 정제로 제공됩니다.
표 1. Everolimus 정제 설명
| 투여량 |
0.25 mg |
0.5 mg |
0.75 mg |
1 mg |
| 외관 |
한쪽 면에 “EVR”이 새겨지고 다른 쪽 면에 “25”가 새겨진 흰색에서 약간 흰색을 띠는 둥근 정제. |
한쪽 면에 “EVR”이 새겨지고 다른 쪽 면에 “50”가 새겨진 흰색에서 약간 흰색을 띠는 둥근 정제. | 한쪽 면에 “EVR”이 새겨지고 다른 쪽 면에 “75”가 새겨진 흰색에서 약간 흰색을 띠는 둥근 정제. |
한쪽 면에 “EVR”이 새겨지고 다른 쪽 면에 “100”가 새겨진 흰색에서 약간 흰색을 띠는 둥근 정제. |
4 금기사항
5 경고 및 주의사항
5.1 면역억제 관리
이식에서 전신 면역억제제 치료 관리 경험이 있는 의사만 에베로리무스를 처방해야 합니다. 이 약을 투여받는 환자는 적절한 실험실 및 지원 의료 자원을 갖춘 시설에서 관리해야 합니다. 유지 요법을 담당하는 의사는 환자의 추적 관찰에 필요한 완전한 정보를 가지고 있어야 합니다. 칼시뉴린 억제제(CNI)를 완전히 제거한 제한된 데이터에서 급성 거부 반응의 위험이 증가했습니다.
5.2 림프종 및 기타 악성 종양
에베로리무스를 포함한 면역억제제를 투여받는 환자는 림프종과 피부암을 비롯한 기타 악성 종양이 발생할 위험이 증가합니다. 이러한 위험은 특정 약제의 사용보다는 면역억제의 강도 및 기간과 관련이 있는 것으로 보입니다.
피부암 위험이 증가한 환자의 경우 일반적으로 보호복을 착용하고 자외선 차단 지수가 높은 자외선 차단제를 사용하여 햇빛 및 자외선에 대한 노출을 제한해야 합니다.
5.3 심각한 감염
에베로리무스를 포함한 면역억제제를 투여받는 환자는 기회 감염을 포함하여 세균, 바이러스, 진균 및 원생동물 감염이 발생할 위험이 증가합니다 [경고 및 주의사항 (5.13), 이상반응 (6.1, 6.2) 참조]. 이러한 감염은 치명적인 결과를 포함하여 심각한 결과를 초래할 수 있습니다. 감염에 대한 감수성을 증가시킬 수 있는 과도한 면역억제의 위험 때문에 복합 면역억제제 요법은 주의해서 사용해야 합니다.
이식 환자에게는 Pneumocystis jiroveci (carinii) 폐렴에 대한 항균 예방과 거대세포바이러스(CMV)에 대한 예방이 권장됩니다.
5.5 간동맥 혈전증
라파마이신의 포유류 표적(mTOR) 억제제는 간동맥 혈전증(HAT)의 증가와 관련이 있습니다. 보고된 사례는 대부분 이식 후 처음 30일 이내에 발생했으며 대부분 이식편 손실 또는 사망으로 이어졌습니다. 따라서 에베로리무스는 간 이식 후 30일 이전에는 투여해서는 안 됩니다.
5.6 에베로리무스 및 칼시뉴린 억제제 유발 신독성
신장 이식 환자에서 표준 용량의 사이클로스포린과 함께 에베로리무스를 투여하면 신독성 위험이 증가하여 사구체 여과율이 감소합니다. 신기능 장애를 줄이기 위해 에베로리무스와 병용하려면 감량된 용량의 사이클로스포린이 필요합니다[경고, 적응증 및 사용(1.1), 임상 약리학(12.8) 참조].
간 이식 환자에서 에베로리무스는 표준 용량의 타크롤리무스와 함께 연구되지 않았습니다. 신독성의 잠재적 위험을 최소화하기 위해 에베로리무스와 병용하려면 감량된 용량의 타크롤리무스를 사용해야 합니다[적응증 및 사용(1.2), 임상 약리학(12.9) 참조].
에베로리무스 투여 중 신기능을 모니터링해야 합니다. 용량 조정 후에도 신기능이 개선되지 않거나 기능 장애가 약물과 관련된 것으로 생각되는 경우 다른 면역억제제 요법으로 전환하는 것을 고려하십시오. 신기능을 손상시키는 것으로 알려진 다른 약물을 사용할 때는 주의해야 합니다.
5.7 심장 이식
새로운 심장 이식 환자를 대상으로 한 임상 시험에서 유도 요법의 유무에 관계없이 면역억제 요법에서 에베로리무스를 투여한 결과 대조 요법에 비해 이식 후 처음 3개월 이내에 종종 심각한 감염과 관련된 사망률이 증가했습니다. 심장 이식에서 에베로리무스의 사용은 권장되지 않습니다.
5.8 혈관부종
에베로리무스는 혈관부종 발생과 관련이 있습니다. 안지오텐신 전환 효소(ACE) 억제제와 같이 혈관부종을 유발하는 것으로 알려진 다른 약물과 에베로리무스를 병용하면 혈관부종이 발생할 위험이 증가할 수 있습니다.
5.9 상처 치유 및 체액 축적
에베로리무스는 상처 치유 지연 위험을 증가시키고 상처 열개, 상처 감염, 절개 탈장, 림프류 및 장액종과 같은 상처 관련 합병증의 발생률을 증가시킵니다. 이러한 상처 관련 합병증에는 더 많은 외과적 개입이 필요할 수 있습니다. 말초 부종(예: 림프부종) 및 심낭 및 흉막 삼출액 및 복수와 같은 다른 유형의 국소 체액 축적을 포함한 전신 체액 축적도 보고되었습니다.
5.10 간질성 폐질환(ILD)/비감염성 폐렴
감염성 폐렴과 일치하는 증상을 보이지만 항생제 치료에 반응하지 않고 적절한 검사를 통해 감염성, 종양성 및 기타 비 약물적 원인이 배제된 환자의 경우 간질성 폐질환(ILD) 진단을 고려해야 합니다. 라파마이신 및 그 유도체(에베롤리무스 포함)를 투여받은 환자에서 폐 실질 내 염증(폐렴) 및/또는 비감염성 원인의 섬유증을 의미하는 ILD 사례가 발생했으며, 일부는 2차 사건으로 폐동맥 고혈압[폐동맥 고혈압(PAH) 포함]을 동반한 것으로 보고되었습니다. 대부분의 경우 일반적으로 글루코코르티코이드 치료를 병행하거나 병행하지 않고 약물 중단 시 해결됩니다. 그러나 사망 사례도 발생했습니다.
5.11 고지혈증
에베롤리무스 시작 후 혈청 콜레스테롤 및 트리글리세리드 증가로 인해 지질 저하 치료가 필요한 것으로 보고되었으며, 에베롤리무스 전체 혈액 최저 농도가 높을수록 고지혈증 위험이 증가합니다 [부작용 (6.2) 참조]. 지질 저하 치료를 사용해도 에베롤리무스를 투여받는 환자의 지질 수치가 정상화되지 않을 수 있습니다.
에베롤리무스를 투여받는 모든 환자는 고지혈증을 모니터링해야 합니다. 고지혈증이 발견되면 국립 콜레스테롤 교육 프로그램 가이드라인에 따라 식이 요법, 운동 및 지질 저하제와 같은 중재를 시작해야 합니다. 에베롤리무스를 함유한 면역억제 요법을 시작하기 전에 고지혈증이 있는 환자의 경우 위험/이점을 고려해야 합니다. 마찬가지로 중증의 불응성 고지혈증 환자의 경우 에베롤리무스 치료 지속 여부를 재평가해야 합니다. 에베롤리무스는 기준 콜레스테롤 수치가 350mg/dL을 초과하는 환자를 대상으로 연구되지 않았습니다.
사이클로스포린과의 상호 작용으로 인해 신장 이식 환자를 대상으로 한 에베롤리무스와 사이클로스포린의 임상 시험에서는 환자가 HMG-CoA 환원효소 억제제인 심바스타틴과 로바스타틴을 투여받지 않도록 강력히 권고했습니다. 사이클로스포린과 함께 에베롤리무스 치료를 받는 동안 HMG-CoA 환원효소 억제제 및/또는 피브레이트를 투여받은 환자는 이러한 약물의 각 라벨에 설명된 대로 횡문근융해증 및 기타 부작용이 발생할 가능성이 있는지 모니터링해야 합니다 [약물 상호 작용 (7.7) 참조].
5.12 단백뇨
이식 환자에서 에베롤리무스 사용은 단백뇨 증가와 관련이 있습니다. 단백뇨 위험은 에베롤리무스 전체 혈액 최저 농도가 높을수록 증가했습니다. 에베롤리무스를 투여받는 환자는 단백뇨를 모니터링해야 합니다 [부작용 (6.2) 참조].
5.13 폴리오마 바이러스 감염
에베롤리무스를 포함한 면역억제제를 투여받는 환자는 폴리오마 바이러스 감염을 포함한 기회 감염 위험이 증가합니다. 이식 환자의 폴리오마 바이러스 감염은 심각하고 때로는 치명적인 결과를 초래할 수 있습니다. 여기에는 주로 BK 바이러스 감염으로 인한 폴리오마 바이러스 관련 신장병증(PVAN)과 JC 바이러스 관련 진행성 다초점 백질뇌병증(PML)이 포함됩니다. PVAN은 에베롤리무스를 포함한 면역억제제를 투여받는 환자에서 관찰되었습니다. PVAN은 신기능 저하 및 신장 이식 거부를 포함한 심각한 결과와 관련이 있습니다 [부작용 (6.2) 참조]. 환자 모니터링은 PVAN 위험이 있는 환자를 감지하는 데 도움이 될 수 있습니다. PVAN 또는 PML의 증거가 나타나는 환자의 경우 면역억제 감소를 고려해야 합니다. 의사는 또한 면역억제 감소가 동종 이식 기능에 미치는 위험을 고려해야 합니다.
5.14 CYP3A4의 강력한 억제제 및 유도제와의 상호 작용
에베롤리무스를 강력한 CYP3A4 억제제(예: 케토코나졸, 이트라코나졸, 보리코나졸, 클라리스로마이신, 텔리트로마이신, 리토나비르, 보세프레비르, 텔라프레비르) 또는 강력한 CYP3A4 유도제(예: 리팜피신, 리파부틴)와 함께 투여하는 것은 에베롤리무스 전체 혈액 최저 농도를 면밀히 모니터링하지 않는 한 권장되지 않습니다 [약물 상호 작용 (7) 참조].
5.15 혈전성 미세혈관병증/혈전성 혈소판 감소성 자반증/용혈성 요독 증후군
에베롤리무스와 사이클로스포린을 병용하면 혈전성 미세혈관병증(TMA)/혈전성 혈소판 감소성 자반증(TTP)/용혈성 요독 증후군(HUS)의 위험이 증가할 수 있습니다. 혈액학적 매개변수를 모니터링하십시오 [부작용 (6.2) 참조].
5.16 이식 후 새롭게 발생하는 당뇨병
에베롤리무스는 이식 후 새롭게 발생하는 당뇨병의 위험을 증가시키는 것으로 나타났습니다. 에베롤리무스를 사용하는 환자의 혈당 농도를 면밀히 모니터링해야 합니다.
5.17 배아-태아 독성
동물 연구 및 작용 기전에 따르면 [임상 약리학 (12.1) 참조], 에베롤리무스는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. 동물 연구에서 에베롤리무스는 권장되는 최저 시작 용량에서의 인체 노출량과 같거나 낮은 모체 노출량에서 기관 형성 기간 동안 투여 시 배아-태아 독성을 유발했습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 가임 여성에게는 에베롤리무스를 사용하는 동안과 치료 종료 후 8주 동안 임신을 피하고 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 (8.1, 8.3) 참조].
5.18 남성 불임
무정자증이나 정자 감소증이 나타날 수 있습니다 [부작용 (6.2), 비임상 독성학 (13.1) 참조]. Everolimus는 항증식제이며 생식 세포와 같이 빠르게 분열하는 세포에 영향을 미칩니다.
5.19 예방 접종
Everolimus 치료 중에는 생백신을 사용하면 안 됩니다. 예를 들어 비강 내 인플루엔자, 홍역, 유행성 이하선염, 풍진, 경구용 소아마비, BCG, 황열병, 수두 및 TY21a 장티푸스 백신 등이 있습니다(이에 국한되지 않음).
5.20 자몽 주스와의 상호 작용
자몽과 자몽 주스는 사이토크롬 P450 3A4 및 P-gp 활성을 억제하므로 everolimus 및 cyclosporine 또는 tacrolimus와 함께 사용해서는 안 됩니다.
5.21 유전 질환/기타 환자
갈락토스 불내성, Lapp 유당분해효소 결핍증 또는 포도당-갈락토스 흡수장애와 같은 드문 유전 질환이 있는 환자는 설사 및 흡수장애가 발생할 수 있으므로 everolimus를 복용해서는 안 됩니다.
5.22 칸나비디올 약물 상호 작용
칸나비디올과 everolimus 를 병용 투여할 경우, everolimus 혈중 농도 증가 및 everolimus 독성을 시사하는 이상 반응에 대해 면밀히 모니터링해야 합니다. everolimus 를 칸나비디올과 병용 투여할 경우 필요에 따라 everolimus 용량 감량을 고려해야 합니다 [용량 및 투여 (2.3), 약물 상호 작용 (7.13) 참조].
6 부작용
6.1 심각한 및 기타 중요한 유해 반응
다음 유해 반응은 라벨의 다른 섹션에서 자세히 설명됩니다.
• 과민 반응 [금기 사항 (4.1) 참조]
• 림프종 및 기타 악성 종양 [경고 및 주의 사항 (5.2)의 경고 참조]
• 심각한 감염 [경고 및 주의 사항 (5.3) 참조]
• 신장 이식편 혈전증 [경고 및 주의 사항 (5.4) 참조]
• 간 동맥 혈전증 [경고 및 주의 사항 (5.5) 참조]
• 에베롤리무스 및 칼시뉴린 억제제 유발 신장 독성 [경고 및 주의 사항 (5.6) 참조]
• 심장 이식 [경고 및 주의 사항 (5.7) 참조]
• 안지오에데마 [경고 및 주의 사항 (5.8) 참조]
• 상처 치유 및 체액 축적 [경고 및 주의 사항 (5.9) 참조]
• 간질성 폐 질환/비감염성 폐렴 [경고 및 주의 사항 (5.10) 참조]
• 고지혈증 [경고 및 주의 사항 (5.11) 참조]
• 단백뇨 [경고 및 주의 사항 (5.12) 참조]
• 폴리오마 바이러스 감염 [경고 및 주의 사항 (5.13) 참조]
• 혈전성 미세 혈관 병증/혈전성 혈소판 감소성 자반증/용혈성 요독 증후군 (TMA/TTP/HUS) [경고 및 주의 사항 (5.15) 참조]
• 이식 후 신규 발병 당뇨병 [경고 및 주의 사항 (5.16) 참조]
• 남성 불임 [경고 및 주의 사항 (5.18) 참조]
6.2 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로 관찰된 유해 반응 발생률을 다른 시험의 발생률과 직접 비교할 수 없으며 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
신장 이식
아래에 설명된 데이터는 초기 에베롤리무스 투여량 1.5mg/일(표적 골 농도 3~8ng/mL, 감소된 노출 사이클로스포린(N=274)과 표준 노출 사이클로스포린(N=273)을 사용한 미코페놀산 비교)의 농도 조절 에베롤리무스를 사용한 신장 이식 환자의 새 이식 대상자에 대한 개방형 무작위 시험에서 에베롤리무스 노출을 반영합니다. 모든 환자는 바실릭시맙 유도 요법과 코르티코스테로이드를 받았습니다. 모집단은 18~70세였으며, 43% 이상이 50세 이상이었습니다(에베롤리무스군 평균 연령 46세, 대조군 평균 연령 47세). 대부분의 수혜자는 남성이었습니다(에베롤리무스군 64%, 대조군 69%). 대부분의 환자는 백인이었습니다(에베롤리무스군 70%, 대조군 69%). 인구 통계적 특징은 치료군 간에 유사했습니다. 이식으로 이어진 가장 흔한 질환은 군 간에 균형을 이루었으며 고혈압/신경 경화증, 사구체 신염/사구체 질환 및 당뇨병을 포함했습니다.
에베롤리무스 1.5mg/일 치료를 중단한 환자 수(83/277, 30%)가 대조군 요법을 중단한 환자 수(60/277, 22%)보다 유의하게 많았습니다. 조기 치료 중단 환자 중 대부분의 중단은 유해 반응 때문이었습니다. 에베롤리무스군 18% 대 대조군 9%(p-값 = 0.004). 이 차이는 여성 환자의 치료군 간에 더 두드러졌습니다. 연구 약물을 중단한 환자의 경우 유해 반응은 연구 약물 중단 후 7일까지 수집되었고 심각한 유해 반응은 연구 약물 중단 후 30일까지 수집되었습니다.
더 높은 용량(3mg/일)에서 에베롤리무스 중단은 95/279, 34%였으며, 이 중 20%는 유해 반응 때문이었습니다. 이 요법은 권장되지 않습니다(아래 참조).
심각한 유해 반응의 전반적인 발생률은 에베롤리무스군에서 57%(159/278)이고 미코페놀산군에서 52%(141/273)였습니다. 심각한 유해 반응으로 보고된 감염 및 기생충은 두 군 모두에서 가장 높은 발생률을 보였습니다[에베롤리무스군 20%(54/274), 대조군 25%(69/273)]. 이 차이는 주로 미코페놀산군에서 바이러스 감염, 특히 CMV 및 BK 바이러스 감염의 발생률이 높기 때문입니다. 심각한 유해 반응으로 보고된 손상, 중독 및 절차적 합병증은 두 군 모두에서 두 번째로 높은 발생률을 보였습니다[에베롤리무스군 14%(39/274), 대조군 12%(32/273)]. 그 다음으로 신장 및 비뇨기 질환[에베롤리무스군 10%(28/274), 대조군 13%(36/273)]과 혈관 질환[에베롤리무스군 10%(26/274), 대조군 7%(20/273)]이 뒤를 이었습니다.
연구 첫 12개월 동안 총 13명의 환자가 사망했습니다. 에베롤리무스군 7명(3%), 대조군 6명(2%). 연구군 전반에 걸쳐 가장 흔한 사망 원인은 심장 질환 및 감염과 관련이 있었습니다.
12개월 연구 기간 동안 에베롤리무스군에서 12건(4%), 대조군에서 8건(3%)의 이식편 손실이 발생했습니다. 이식편 손실 중 4건은 에베롤리무스군에서 신장 동맥 혈전증 2건과 신장 정맥 혈전증 2건(2%)으로 인한 것이었고, 대조군에서는 신장 동맥 혈전증 2건(1%)으로 인한 것이었습니다[경고, 경고 및 주의 사항(5.4) 참조].
에베롤리무스군에서 관찰된 가장 흔한(20% 이상) 유해 반응은 다음과 같습니다. 말초 부종, 변비, 고혈압, 메스꺼움, 빈혈, 요로 감염 및 고지혈증.
감염
유해 반응으로 보고된 세균, 진균 및 바이러스 감염의 전반적인 발생률은 대조군(68%)에서 에베롤리무스군(64%)보다 높았으며, 주로 바이러스 감염의 수가 증가했기 때문입니다(대조군 21%, 에베롤리무스군 10%). 유해 반응으로 보고된 CMV 감염의 발생률은 대조군에서 8%, 에베롤리무스군에서 1%였습니다. 대조군에서 심각한 CMV 감염의 3% 대 에베롤리무스군에서 0%는 심각한 것으로 간주되었습니다[경고 및 주의 사항(5.3) 참조].
BK 바이러스
BK 바이러스 감염의 발생률은 에베롤리무스군(2명, 1%)에서 대조군(11명, 4%)보다 낮았습니다. 에베롤리무스군의 2건의 BK 바이러스 감염 중 1건과 대조군의 11건의 BK 바이러스 감염 중 2건도 심각한 유해 반응으로 보고되었습니다. BK 바이러스 감염은 임상 시험의 어떤 군에서도 이식편 손실로 이어지지 않았습니다.
상처 치유 및 체액 수집
상처 치유 관련 반응은 회고적 검색 및 추가 데이터 요청을 통해 확인되었습니다. 림프낭, 혈청종, 혈종, 탈출, 절개 탈장 및 감염을 포함한 상처 관련 반응의 전반적인 발생률은 에베롤리무스군에서 35%, 대조군에서 26%였습니다. 에베롤리무스군에서 대조군보다 절개 상처 합병증의 수술 중 수복, 박리 또는 배액이 필요한 환자 수가 많았고 림프낭 및 혈청종 배액이 필요한 환자 수가 많았습니다.
부종 및 기타 유형의 체액 수집과 같은 주요 체액 수집으로 인한 유해 반응은 에베롤리무스군에서 45%, 대조군에서 40%였습니다[경고 및 주의 사항(5.9) 참조].
신생물
악성 및 양성 신생물로 인한 유해 반응은 에베롤리무스군 환자의 3%, 대조군 환자의 6%에서 보고되었습니다. 대조군에서 가장 흔하게 보고된 신생물은 기저 세포암, 편평 세포암, 피부 유두종 및 지루 각화증이었습니다. 이식 전 흑색종 절제술을 받은 에베롤리무스군 환자 1명이 전이성 흑색종으로 사망했습니다[경고, 경고 및 주의 사항(5.2) 참조].
새로운 발병 당뇨병(NODM)
유해 반응 및 무작위 혈청 포도당 값을 기반으로 보고된 NODM은 에베롤리무스군에서 9%, 대조군에서 7%였습니다.
남성의 내분비 효과
에베롤리무스군에서 혈청 테스토스테론 수치는대조군에서는 유의미한 변화가 관찰되지 않은 반면, 에베롤리무스 군에서는 FSH 수치가 유의미하게 증가했습니다. 에베롤리무스 군과 대조군 모두에서 평균 테스토스테론 및 FSH 수치는 정상 범위 내에 유지되었으며, 에베롤리무스 군의 평균 FSH 수치는 정상 범위의 상한선(11.1 U/L)에 있었습니다. 에베롤리무스 치료군에서 대조군(각각 5% 대 2%)에 비해 발기 부전이 더 많이 보고되었습니다.
표 2는 에베롤리무스를 감소된 용량의 사이클로스포린 또는 마이코페놀산과 표준 용량의 사이클로스포린과 함께 투여받은 환자에서 보고된 치료 발생 이상 반응의 발생률을 비교한 것입니다. 각 MedDRA 기관계 내에서 이상 반응은 발생률이 높은 순서대로 제시됩니다.
표 2. 빈번한(어떤 치료군에서든 10% 이상) 이상 반응의 발생률(안전성 모집단*)
| 이상 반응 | 에베롤리무스 1.5 mg 감소된 노출 사이클로스포린과 함께 N=274 n (%) |
마이코페놀산 1.44 g 표준 노출 사이클로스포린과 함께 N=273 n (%) |
| 모든 이상 반응* |
271 (99) |
270 (99) |
| 혈액 및 림프계 장애 |
93 (34) |
111 (41) |
| 빈혈 | 70 (26) |
68 (25) |
| 백혈구 감소증 | 8 (3) |
33 (12) |
| 위장 장애 |
196 (72) |
207 (76) |
| 변비 | 105 (38) |
117 (43) |
| 메스꺼움 | 79 (29) |
85 (31) |
| 설사 | 51 (19) |
54 (20) |
| 구토 | 40 (15) |
60 (22) |
| 복통 | 36 (13) |
42 (15) |
| 소화 불량 | 12 (4) |
31 (11) |
| 상복부 통증 | 9 (3) |
30 (11) |
| 일반적인 장애 및 투여 부위 상태 |
181 (66) |
160 (59) |
| 말초 부종 | 123 (45) |
108 (40) |
| 발열 | 51 (19) |
40 (15) |
| 피로 | 25 (9) |
28 (10) |
| 감염 및 기생충 감염 |
169 (62) |
185 (68) |
| 요로 감염 | 60 (22) |
63 (23) |
| 상기도 감염 | 44 (16) |
49 (18) |
| 손상, 중독 및 시술 합병증 |
163 (60) |
163 (60) |
| 절개 부위 통증 | 45 (16) |
47 (17) |
| 시술 통증 | 40 (15) |
37 (14) |
| 검사 |
137 (50) |
133 (49) |
| 혈액 크레아티닌 증가 | 48 (18) |
59 (22) |
| 대사 및 영양 장애 |
222 (81) |
199 (73) |
| 고지혈증 | 57 (21) |
43 (16) |
| 고칼륨혈증 | 49 (18) |
48 (18) |
| 고콜레스테롤혈증 | 47 (17) |
34 (13) |
| 지질 이상증 | 41 (15) |
24 (9) |
| 저마그네슘혈증 | 37 (14) |
40 (15) |
| 저인산혈증 | 35 (13) |
35 (13) |
| 고혈당증 | 34 (12) |
38 (14) |
| 저칼륨혈증 | 32 (12) |
32 (12) |
| 근골격계 및 결합 조직 장애 |
112 (41) |
105 (39) |
| 사지 통증 | 32 (12) |
29 (11) |
| 요통 | 30 (11) |
28 (10) |
| 신경계 장애 |
92 (34) |
109 (40) |
| 두통 | 49 (18) |
40 (15) |
| 떨림 | 23 (8) |
38 (14) |
| 정신 장애 |
90 (33) |
72 (26) |
| 불면증 | 47 (17) |
43 (16) |
| 신장 및 요로 장애 |
112 (41) |
124 (45) |
| 혈뇨 | 33 (12) |
33 (12) |
| 배뇨곤란 | 29 (11) |
28 (10) |
| 호흡기, 흉곽 및 종격 장애 |
86 (31) |
93 (34) |
| 기침 | 20 (7) |
30 (11) |
| 혈관 장애 |
122 (45) |
124 (45) |
| 고혈압 | 81 (30) |
82 (30) |
* 안전성 분석 모집단은 적어도 1회 이상 치료를 받고 기준선 이후 안전성 평가를 적어도 1회 이상 받은 무작위 배정된 신장 이식 환자로 정의됩니다.
에베롤리무스 1.5mg군에서 대조군에 비해 빈도가 5% 이상 높았던 이상 반응은 다음과 같습니다: 말초 부종(45% 대 40%), 고지혈증(21% 대 16%), 이상 지질혈증(15% 대 9%), 구내염/구강 궤양(8% 대 3%).
에베롤리무스 3mg/일(1.5mg 1일 2회; 목표 골 농도 6~12ng/mL)로 감소된 노출 시클로스포린을 투여한 세 번째 치료군이 위에서 설명한 연구에 포함되었습니다. 낮은 용량의 에베롤리무스군과 마찬가지로 효과적이었지만 전반적인 안전성은 더 나빴고, 그 결과 에베롤리무스의 더 높은 용량은 권장할 수 없습니다. 279명의 환자 중 95명(34%)이 연구 약물을 중단했으며, 그 중 57명(20%)이 이상 반응으로 인해 중단했습니다. 이 더 높은 용량으로 사용했을 때 에베롤리무스 중단으로 이어진 가장 흔한 이상 반응은 손상, 중독 및 절차적 합병증(에베롤리무스 1.5mg: 5%, 에베롤리무스 3mg: 7%, 대조군: 2%), 감염(2%, 6%, 3%), 신장 및 비뇨기 질환(4%, 7%, 4%), 위장관 질환(1%, 3%, 2%)이었습니다.
이전 신장 임상 시험에서 고정 용량 에베롤리무스와 표준 용량의 시클로스포린을 병용하면 혈청 크레아티닌 수치가 자주 상승했으며, 감소된 노출 시클로스포린을 사용한 현재 연구에서 관찰된 것보다 평균 및 중간 혈청 크레아티닌 값이 더 높았습니다. 이러한 결과는 에베롤리무스가 시클로스포린 유발 신장 독성을 증가시키므로 감소된 노출 시클로스포린을 사용한 농도 조절 요법에서만 사용해야 함을 나타냅니다. [경고, 적응증 및 사용법 (1.1), 경고 및 주의 사항 (5.6) 참조].
간 이식
아래에 설명된 데이터는 개방 표지, 무작위 배정된 간 이식 환자 연구에서 이식 후 30일부터 에베롤리무스에 대한 노출을 반영합니다. 포함/제외 기준을 충족한 719명의 환자 [임상 연구 (14.2) 참조] 는 연구의 세 가지 치료군 중 하나에 무작위 배정되었습니다. 무작위 배정 전 30일 동안 환자는 미코페놀레이트 모페틸 유무에 관계없이 타크로리무스와 코르티코스테로이드를 투여받았습니다(약 70~80%가 MMF를 투여받았습니다). 유도 항체는 투여되지 않았습니다. 무작위 배정 시 MMF는 중단되었고 환자는 에베롤리무스 초기 용량 1mg 1일 2회(1일 2mg)로 무작위 배정되었으며, 감소된 노출 타크로리무스[프로토콜에서 지정한 목표 골 농도 3~5ng/mL]와 함께 프로토콜에서 지정한 목표 골 농도 3~8ng/mL로 조정되었습니다(N=245) [임상 약리학 (12.7, 12.9) 참조] 또는 표준 노출 타크로리무스 대조군[프로토콜에서 지정한 목표 골 농도는 이식 후 4개월까지 8~12ng/mL, 이식 후 4개월부터 12개월까지 6~10ng/mL](N=241)으로 무작위 배정되었습니다. 세 번째 무작위 배정된 군은 조기에 중단되었으며 [임상 연구 (14.2) 참조] 이 섹션에서는 설명하지 않습니다. 모집단은 18~70세였으며, 50세 이상이 50%를 넘었습니다(에베롤리무스군의 평균 연령은 54세, 타크로리무스 대조군의 평균 연령은 55세); 에베롤리무스군과 대조군 모두에서 각각 남성이 74%였으며, 대부분이 백인이었습니다(에베롤리무스군 86%, 대조군 80%). 인구 통계적 특징은 치료군 간에 비슷했습니다. 이식으로 이어진 가장 흔한 질환은 군 간에 균형을 이루었습니다. 말기 간 질환(ESLD)의 가장 흔한 원인은 알코올성 간경변, C형 간염 및 간세포암이었으며, 군 간에 균형을 이루었습니다.
연구 시작 후 12개월 동안 에베롤리무스군에서 27%(27%)가 연구 약물을 중단한 반면, 타크로리무스 대조군에서는 22%가 중단했습니다. 연구 약물 중단의 가장 흔한 이유는 이상 반응(각각 19% 및 11%) 때문이었으며, 여기에는 에베롤리무스군의 단백뇨, 재발성 C형 간염 및 범혈구 감소증이 포함됩니다. 24개월 시점에서 간 이식 환자의 연구 약물 중단율은 에베롤리무스군(42%)이 타크로리무스 대조군(33%)보다 높았습니다.
12개월 시점에서 심각한 이상 반응의 전반적인 발생률은 에베롤리무스군에서 50%(122/245), 대조군에서 43%(104/241)였으며, 24개월 시점에서 비슷했습니다(각각 56% 및 54%). 감염 및 기생충 감염은 가장 높은 발생률로 심각한 이상 반응으로 보고되었으며, 그 뒤를 위장관 질환과 간담도 질환이 이었습니다.
연구 시작 후 12개월 동안 에베롤리무스군에서 13명의 사망자가 보고되었습니다(1명의 환자는 에베롤리무스를 복용하지 않았습니다). 같은 12개월 동안 타크로리무스 대조군에서 7명의 사망자가 보고되었습니다. 사망은 두 군 모두에서 다양한 이유로 발생했으며, 대부분 간 관련 문제, 감염 및 패혈증과 관련이 있었습니다. 연구 후 12개월 동안 각 치료군에서 추가로 4명의 사망자가 보고되었습니다.
에베롤리무스군에서 가장 흔한 이상 반응(모든 군에서 10% 이상의 환자에게 보고됨)은 다음과 같습니다: 설사, 두통, 말초 부종, 고혈압, 메스꺼움, 발열, 복통, 백혈구 감소증(표 3 참조).
감염
이상 반응으로 보고된 감염의 전반적인 발생률은 에베롤리무스군에서 50%, 대조군에서 44%였으며, 24개월 시점에서 비슷했습니다(각각 56% 및 52%). 감염 유형은 다음과 같이 보고되었습니다: 세균 감염 16% 대 12%, 바이러스 감염 17% 대 13%; 곰팡이 감염은 에베롤리무스군에서 2% 대 대조군에서 5% [경고 및 주의 사항 (5.3) 참조].
상처 치유 및 체액 축적
상처 치유 합병증은 24개월까지 에베롤리무스군 환자의 11%, 대조군 환자의 8%에서 이상 반응으로 보고되었습니다. 흉막 삼출은 두 군 모두에서 5%에서 보고되었으며, 복수는 에베롤리무스군 환자의 4%, 대조군 환자의 3%에서 보고되었습니다.
신생물
악성 및 양성 신생물은 12개월 시점에서 에베롤리무스군 환자의 4%, 대조군 환자의 7%에서 이상 반응으로 보고되었습니다. 에베롤리무스군에서는 3개의 악성 종양이 보고된 반면, 대조군에서는 9건이 보고되었습니다. 에베롤리무스군의 경우 림프종, 림프 증식성 질환 및 간세포암이 포함되었으며, 대조군의 경우 카포시 육종(2건), 전이악성 종양
에베롤리무스는 이식 거부 반응을 예방하기 위해 사용되는 면역 억제제입니다. 에베롤리무스는 암의 위험을 증가시킬 수 있습니다. 에베롤리무스로 치료받은 환자에서 림프종, 폐암, 신장암, 결장 직장암, 교모세포종, 악성 간 종양, 췌장 신경 내분비 종양, 혈구 탐식성 조직구증 및 편평 세포 암종이 보고되었습니다. 24개월 시점에서 악성 종양 발생률은 유사했습니다(각각 10% 및 11%) [경고, 경고 및 주의 사항 참조 (5.2)].
지질 이상
고지혈증 부작용(선호 용어 포함: 고지혈증, 고콜레스테롤혈증, 혈중 콜레스테롤 증가, 혈중 트리글리세리드 증가, 고중성지방혈증 지질 증가, 총 콜레스테롤/HDL 비율 증가 및 지질 이상)은 12개월 시점에서 에베롤리무스 환자의 24%와 대조군 환자의 10%에서 보고되었습니다. 24개월 시점에서 결과는 유사했습니다(각각 28% 및 12%).
이식 후 신규 발병 당뇨병(NODAT)
무작위 배정 시 당뇨병이 없었던 환자의 경우, 12개월 시점에서 에베롤리무스 그룹에서 NODAT가 32%로 보고된 반면 대조군 그룹에서는 29%였으며 24개월 시점에서 유사했습니다.
표 3은 무작위 배정부터 24개월까지 에베롤리무스와 감소된 노출 타크로리무스 또는 표준 용량 타크로리무스를 투여받은 환자에서 발생률이 10% 이상인 치료 관련 부작용의 발생률을 비교합니다. 각 MedDRA 기관계 내에서 부작용은 발생률이 높은 순서대로 제시됩니다.
표 3. 간 이식 후 12개월 및 24개월 시점에서 가장 흔한(모든 치료 그룹에서 10% 이상) 부작용의 발생률(안전성 모집단*)
| 부작용 |
12개월 |
24개월 |
||
| 감소된 노출 타크로리무스와 함께 에베롤리무스 N=245 n (%) |
표준 노출 타크로리무스 N=241 n (%) |
감소된 노출 타크로리무스와 함께 에베롤리무스 N=245 n (%) |
표준 노출 타크로리무스 N=242 n (%) |
|
| 모든 부작용/감염 |
232 (95) | 229 (95) | 236 (96) | 237 (98) |
| 혈액 및 림프계 장애 |
66 (27) | 47 (20) | 79 (32) | 58 (24) |
| –백혈구 감소증 | 29 (12) | 12 (5) | 31 (13) | 12 (5) |
| 위장 장애 |
136 (56) | 121 (50) | 148 (60) | 138 (57) |
| -설사 | 47 (19) | 50 (21) | 59 (24) | 61 (25) |
| -메스꺼움 | 33 (14) | 28 (12) | 36 (15) | 33 (14) |
| -복통 | 32 (13) | 22 (9) | 37 (15) | 31(13) |
| 일반적인 장애 및 투여 부위 상태 |
94 (38) | 85 (35) | 113 (46) | 98 (41) |
| -말초 부종 | 43 (18) | 26 (11) | 49 (20) | 31 (13) |
| -발열 | 32 (13) | 25 (10) | 43 (18) | 28 (12) |
| -피로 | 22 (9) | 26 (11) | 27 (11) | 28 (12) |
| 감염 및 기생충 감염 |
123 (50) | 105 (44) | 135 (56) | 125 (52) |
| –C형 간염** | 28 (11) | 19 (8) | 33 (14) | 24 (10) |
| 검사 |
81 (33) | 78 (32) | 92 (38) | 98 (41) |
| –간 기능 검사 이상 | 16 (7) | 24 (10) | 19 (8) | 25 (10) |
| 대사 및 영양 장애 |
111(45) | 92(38) | 134(55) | 106(44) |
| -고콜레스테롤혈증 | 23(9) | 6(3) | 27(11) | 9(4) |
| 신경계 장애 |
89 (36) | 85 (35) | 99 (40) | 101 (42) |
| –두통 | 47 (19) | 46 (19) | 53 (22) | 54 (22) |
| –떨림 | 23 (9) | 29 (12) | 25 (10) | 37 (15) |
| –불면증 | 14 (6) | 19 (8) | 17 (7) | 24 (10) |
| 신장 및 요로 장애 |
49(20) | 53(22) | 67(27) | 73(30) |
| -신부전 | 13(5) | 17(7) | 24(10) | 37(15) |
| 혈관 장애 |
56 (23) | 57 (24) | 72 (29) | 68 (28) |
| –고혈압 | 42 (17) | 38 (16) | 52 (21) | 44 (18) |
* 안전성 분석 모집단은 적어도 1회 이상 치료를 받고 기준선 이후 안전성 평가를 적어도 1회 이상 받은 무작위 배정된 간 이식 환자로 정의됩니다. 주요 기관계는 알파벳순으로 제시됩니다.
** 새로 발생한 C형 간염 사례는 보고되지 않았습니다.**
덜 흔한 유해 반응
에베롤리무스로 치료받은 신장 또는 간 이식 환자의 1% 이상에서 10% 미만에서 발생하는 덜 흔한 유해 반응은 다음과 같습니다.
혈액 및 림프계 장애: 빈혈, 백혈구 증가증, 림프절병증, 호중구 감소증, 범혈구 감소증, 혈소판 증가증, 혈소판 감소증
심장 및 혈관 장애: 협심증, 심방 세동, 심부전 울혈, 심계항진, 빈맥, 고혈압, 고혈압 위기 포함, 저혈압, 심부 정맥 혈전증
내분비 장애: 쿠싱 증후군, 부갑상선 기능 항진증, 갑상선 기능 저하증
안과 질환: 백내장, 결막염, 시력 흐림
위장관 장애: 복부 팽만감, 복부 탈장, 복수, 변비, 소화 불량, 연하 곤란, 상복부 불쾌감, 팽만감, 위염, 위식도 역류 질환, 치은 비대, 토혈, 치핵, 일레우스, 구강 궤양, 복막염, 구내염
일반적인 장애 및 투여 부위 상태: 흉통, 오한, 피로, 절개 부위 탈장, 서혜부 탈장, 권태감, 부종, 전신 부종 포함, 통증
간담도계 장애: 간 효소 증가, 담관 협착, 빌리루빈 증가, 담관염, 담즙 정체, 간염 (비 감염성)
감염 및 기생충 감염: BK 바이러스 감염 [경고 및 주의 사항 (5.13) 참조], 균혈증, 기관지염, 칸디다증, 봉와직염, CMV, 모낭염, 위장염, 헤르페스 감염, 인플루엔자, 하부 호흡기 감염, 비인두염, 조갑진균증, 구강 칸디다증, 구강 헤르페스, 골수염, 폐렴, 신우신염, 패혈증, 부비강염, 무좀, 상부 호흡기 감염, 요도염, 요로 감염, 상처 감염 [경고 및 주의 사항 (5.3) 참조]
손상, 중독 및 수술적 합병증: 절개 부위 합병증, 감염 포함, 신장 주위 농양, 장액종, 상처 열림, 절개 부위 탈장, 신장 주위 혈종, 국소 복강 내 체액 축적, 치유 장애, 림프낭, 림프액 누출
검사: 혈액 알칼리성 인산 가수분해효소 증가, 혈액 크레아티닌 증가, 혈액 포도당 증가, 헤모글로빈 감소, 백혈구 수 감소, 트랜스아미나제 증가
대사 및 영양 장애: 혈액 요소 질소 증가, 산증, 식욕 부진, 탈수, 당뇨병 [경고 및 주의 사항 (5.16) 참조], 식욕 감소, 체액 저류, 통풍, 고칼슘혈증, 고중성지방혈증, 고요산혈증, 저칼슘혈증, 저칼륨혈증, 저혈당증, 저마그네슘혈증, 저나트륨혈증, 철 결핍, 새로 발생한 당뇨병, 비타민 B12 결핍
근골격계 및 결합 조직 장애: 관절통, 관절 부종, 근육 경련, 근력 저하, 근골격계 통증, 근육통, 골관절염, 골괴사, 골감소증, 골다공증, 척추염
신경계 장애: 현기증, 편측 마비, 감각 저하, 졸음, 편두통, 신경통, 감각 이상, 졸음, 실신, 떨림
정신 장애: 초조, 불안, 우울증, 환각
신장 및 요로 장애: 방광 경련, 수신증, 배뇨 긴급증, 간질성 신염, 야뇨증, 빈뇨, 다뇨, 단백뇨 [경고 및 주의 사항 (5.12) 참조], 뇨세포증, 신동맥 혈전증 [경고 및 주의 사항 (5.4) 참조], 급성 신부전, 신장 기능 저하 [경고 및 주의 사항 (5.6) 참조], 신세뇨관 괴사, 요폐
생식기 및 유방 장애: 무월경, 양성 전립선 비대, 발기 부전, 난소 낭종, 음낭 부종
호흡기, 흉곽 및 종격 장애: 무기폐, 기관지염, 호흡 곤란, 기침, 코피, 하부 호흡기 감염, 비충혈, 인후통, 흉막 삼출, 폐부종, 콧물, 부비강 충혈, 천명
피부 및 피하 조직 장애: 여드름, 탈모, 여드름 모양 피부염, 멍, 다모증, 다한증, 다모증, 야간 발한, 가려움증, 발진
혈관 장애: 정맥 혈전색전증 (심부 정맥 혈전증 포함), 정맥염, 폐색전증
에베롤리무스로 치료받은 신장 또는 간 이식 환자의 1% 미만에서 발생하는 덜 흔한 심각한 유해 반응은 다음과 같습니다.
• 안지오에데마 [경고 및 주의 사항 (5.8) 참조]
• 간질성 폐 질환/비 감염성 폐렴 [경고 및 주의 사항 (5.10), 유해 반응 (6.1) 참조]
• 심낭 삼출 [경고 및 주의 사항 (5.9) 참조]
• 췌장염
• 혈전성 미세 혈관 병증 (TMA), 혈전성 혈소판 감소성 자반증 (TTP) 및 용혈성 요독 증후군 (HUS) [경고 및 주의 사항 (5.15) 참조]
6.3 시판 후 경험
에베로리무스와 시클로스포린 병용 요법의 시판 후 사용에서 확인된 부작용으로, 이식 적응증에 특정되지 않은 부작용은 안지오에데마 [경고 및 주의 사항 (5.8) 참조], 홍피증, 백혈구 융해 혈관염, 췌장염, 폐포 단백질증 및 폐색전증이 있습니다. 에베로리무스를 포함한 mTOR 억제제와 관련하여 남성 불임 보고도 있었습니다 [경고 및 주의 사항 (5.18) 참조].
7 약물 상호작용
7.1 CYP3A4 및 P-당단백질의 강력 저해제 또는 유도제와의 상호 작용
에베롤리무스는 주로 간에서 CYP3A4에 의해 대사되고 장벽에서 어느 정도 대사되며, 다약제 배출 펌프인 P-당단백질(P-gp)의 기질입니다. 따라서 전신 흡수된 에베롤리무스의 흡수 및 후속 제거는 CYP3A4 및/또는 P-gp에 영향을 미치는 의약품의 영향을 받을 수 있습니다. CYP3A4의 강력 저해제(예: 케토코나졸, 이트라코나졸, 보리코나졸, 클래리스로마이신, 텔리스로마이신, 리토나비르, 보세프레비르, 텔라프레비르) 및 유도제(예: 리팜피신, 리파부틴)와의 병용 치료는 권장되지 않습니다. P-gp 저해제(예: 디곡신, 사이클로스포린)는 장 세포에서 에베롤리무스의 유출을 감소시키고 에베롤리무스 혈중 농도를 증가시킬 수 있습니다. 시험관 내에서 에베롤리무스는 CYP3A4 및 CYP2D6의 경쟁적 저해제였으며, 잠재적으로 이러한 효소에 의해 제거되는 의약품의 농도를 증가시킵니다. 따라서 치료 지수가 좁은 CYP3A4 및 CYP2D6 기질과 에베롤리무스를 병용 투여할 때는 주의해야 합니다 [용량 및 투여(2.3) 참조].
모든 생체 내 상호 작용 연구는 사이클로스포린을 병용하지 않고 수행되었습니다. 에베롤리무스와 병용 투여되는 약물 간의 약동학적 상호 작용은 아래에서 설명합니다. 아래에 설명된 약물 이외의 약물과의 약물 상호 작용 연구는 수행되지 않았습니다.
7.2 사이클로스포린(CYP3A4/P-gp 저해제 및 CYP3A4 기질)
단회 용량의 사이클로스포린을 병용 투여하면 에베롤리무스의 항정 상태 Cmax 및 곡선 아래 면적(AUC) 추정치가 유의하게 증가했습니다 [임상 약리학(12.5) 참조]. 사이클로스포린 용량이 변경되는 경우 에베롤리무스의 용량 조정이 필요할 수 있습니다 [용량 및 투여(2.3) 참조]. 에베롤리무스는 사이클로스포린(Neoral)을 투여받는 이식 환자에서 사이클로스포린의 약동학에 임상적으로 경미한 영향을 미쳤습니다.
7.3 케토코나졸 및 기타 강력 CYP3A4 저해제
건강한 지원자에게 케토코나졸을 여러 용량 투여한 결과 에베롤리무스 단회 용량의 Cmax, AUC 및 반감기 추정치가 유의하게 증가했습니다. 케토코나졸, 이트라코나졸, 보리코나졸, 클래리스로마이신, 텔리스로마이신, 리토나비르, 보세프레비르, 텔라프레비르와 같은 강력한 CYP3A4 저해제는 에베롤리무스와 병용 투여해서는 안 됩니다 [경고 및 주의 사항(5.14), 임상 약리학(12.5) 참조].
7.4 에리스로마이신(중간 정도의 CYP3A4 저해제)
건강한 지원자에게 에리스로마이신을 여러 용량 투여한 결과 에베롤리무스 단회 용량의 Cmax, AUC 및 반감기 추정치가 유의하게 증가했습니다. 에리스로마이신을 병용 투여하는 경우 에베롤리무스 혈중 농도를 모니터링하고 필요에 따라 용량을 조정해야 합니다 [임상 약리학(12.5) 참조].
7.5 베라파밀(CYP3A4 및 P-gp 기질)
건강한 지원자에게 베라파밀을 여러 용량 투여한 결과 에베롤리무스 단회 용량의 Cmax 및 AUC 추정치가 유의하게 증가했습니다. 에베롤리무스의 반감기는 변경되지 않았습니다. 베라파밀을 병용 투여하는 경우 에베롤리무스 혈중 농도를 모니터링하고 필요에 따라 용량을 조정해야 합니다 [임상 약리학(12.5) 참조].
7.6 아토르바스타틴(CYP3A4 기질) 및 프라바스타틴(P-gp 기질)
건강한 피험자에게 에베롤리무스를 아토르바스타틴 또는 프라바스타틴과 함께 단회 투여한 결과 임상적으로 관련 있는 정도까지 아토르바스타틴, 프라바스타틴 및 에베롤리무스의 약동학뿐만 아니라 혈장에서 총 HMG-CoA 환원 효소 생체 활성에 영향을 미치지 않았습니다. 그러나 이러한 결과를 다른 HMG-CoA 환원 효소 저해제로 외삽할 수는 없습니다.
이러한 제품의 각 라벨에 설명된 대로 횡문근융해증 및 기타 부작용이 발생하는지 환자를 모니터링해야 합니다.
7.7 심바스타틴 및 로바스타틴
사이클로스포린과의 상호 작용으로 인해 신장 이식 환자를 대상으로 사이클로스포린과 함께 에베롤리무스를 사용한 임상 연구에서는 심바스타틴 및 로바스타틴과 같은 HMG-CoA 환원 효소 저해제를 투여받는 환자에게 강력히 권장하지 않았습니다 [경고 및 주의 사항(5.11) 참조].
7.8 리팜피신(강력 CYP3A4/P-gp 유도제)
건강한 피험자에게 여러 용량의 리팜피신을 전처리한 후 에베롤리무스를 단회 투여한 결과 에베롤리무스 청소율이 증가하고 에베롤리무스 Cmax 및 AUC 추정치가 감소했습니다. 리팜피신과의 병용은 권장되지 않습니다 [경고 및 주의 사항(5.14), 임상 약리학(12.5) 참조].
7.9 미다졸람(CYP3A4/5 기질)
여러 용량의 에베롤리무스를 투여한 후 건강한 지원자에게 미다졸람을 단회 투여한 결과 에베롤리무스가 CYP3A4/5의 약한 저해제임이 나타났습니다. 에베롤리무스를 미다졸람 또는 기타 CYP3A4/5 기질과 병용 투여할 때 미다졸람 또는 기타 CYP3A4/5 기질의 용량 조정은 필요하지 않습니다 [임상 약리학(12.5) 참조].
7.10 기타 가능한 상호 작용
CYP3A4 및 P-gp의 중간 정도 억제제는 에베로리무스 혈중 농도를 증가시킬 수 있습니다(예: 플루코나졸, 마크로라이드계 항생제, 니카르디핀, 딜티아젬, 넬피나비르, 인디나비르, 암프레나비르). CYP3A4 유도제는 에베로리무스의 대사를 증가시키고 에베로리무스 혈중 농도를 감소시킬 수 있습니다(예: 세인트존스워트 [Hypericum perforatum], 항경련제: 카르바마제핀, 페노바르비탈, 페니토인, 에파비렌즈, 네비라핀).
7.12 타크로리무스
타크로리무스가 에베로리무스에 미치는 약동학적 상호 작용은 거의 없거나 전혀 없으므로 에베로리무스를 타크로리무스와 병용 투여할 때 에베로리무스의 용량 조 adjustment이 필요하지 않습니다.
7.13 칸나비디올
칸나비디올과 병용 투여하면 에베로리무스의 혈중 농도가 증가할 수 있습니다. 칸나비디올과 Zortress를 병용 투여할 때는 에베로리무스 혈중 농도의 증가 및 에베로리무스 독성을 시사하는 부작용이 있는지 면밀히 모니터링해야 합니다. Zortress를 칸나비디올과 병용 투여할 때는 필요에 따라 Zortress의 용량 감량을 고려해야 합니다 [2.3 용량 및 투여, 5.22 경고 및 주의 사항] 참조).
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 및 작용 기전 [임상 약리학 (12.1) 참조]에 따르면 에베롤리무스는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 임산부에서 에베롤리무스 사용에 대한 사례 보고는 제한적이지만, 이러한 보고는 약물 관련 부작용 발생 위험을 알리기에 충분하지 않습니다. 동물 생식 연구에서 에베롤리무스는 토끼에서 모체 독성을 나타냈으며, 인간 이식 환자에서 달성된 수준과 유사하거나 낮은 노출 수준에서 쥐와 토끼에서 배아-태아 독성을 유발했습니다. 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
지정된 모집단의 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않지만, 미국 일반 모집단에서 주요 선천적 기형의 추정 배경 위험은 임상적으로 인지된 임신의 2%에서 4%이고 유산의 경우 15%에서 20%입니다.
데이터
동물 데이터
에베롤리무스는 태반을 통과하여 태아에 독성을 나타냈습니다.
에베롤리무스를 임신한 쥐에게 교미 전부터 기관 형성까지 매일 경구 투여(0.1 mg/kg, 하루 2회 0.75 mg의 가장 낮은 시작 용량을 투여받은 인간의 노출량의 약 1/10)한 결과, 이식 전 손실 및 배아 흡수가 증가했습니다. 이러한 효과는 모체 독성이 없는 상태에서 발생했습니다.
에베롤리무스를 임신한 토끼에게 기관 형성 동안 매일 경구 투여한 결과, 유산, 모체 독성 및 치사율, 태아 흡수 증가가 발생했습니다. 이러한 용량에서 에베롤리무스에 대한 노출(AUC)은 각각 시작 임상 용량을 투여받은 인간의 노출량의 약 1/10, 1/2 및 1.5배였습니다.
쥐에서의 출산 전 및 출산 후 발달 연구에서 동물은 이식부터 수유까지 투여를 받았습니다. 0.1 mg/kg(0.6 mg/m2)의 용량에서 출산 및 수유에 대한 부작용이나 모체 독성의 징후는 없었지만, 체중 감소(최대 9% 감소) 및 자손 생존율 감소(~5%)가 있었습니다. 자손의 발달 매개변수(형태 발달, 운동 활동, 학습 또는 생식 능력 평가)에 대한 약물 관련 효과는 없었습니다.
8.2 수유
위험 요약
모유에서 에베롤리무스의 존재 여부, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 데이터는 없습니다. 에베롤리무스 및/또는 그 대사산물은 수유 쥐의 모유로 모체 쥐 혈청보다 3.5배 높은 농도로 쉽게 전달됩니다. 쥐에서의 출산 전-출산 후 및 어린 동물 연구에서 출산 후 기간 동안 에베롤리무스에 대한 노출은 발달 독성을 유발했습니다. [특정 모집단에서의 사용 (8.1), 비임상 독성학 (13.2) 참조]. 에베롤리무스에 노출된 영아에게 심각한 부작용이 발생할 가능성이 있으므로 수유 여성에게 모유 수유를 하지 않도록 조언해야 합니다.
8.3 생식 잠재력이 있는 여성 및 남성
피임
여성은 에베롤리무스 정제를 복용하는 동안 임신해서는 안 됩니다. 생식 잠재력이 있는 여성에게 동물 연구에서 에베롤리무스가 모체와 발달 중인 태아에게 해롭다는 것이 밝혀졌음을 알려야 합니다. [특정 모집단에서의 사용 (8.1) 참조]. 생식 잠재력이 있는 여성은 에베롤리무스를 복용하는 동안과 치료를 중단한 후 8주까지 고효율 피임 방법을 사용하는 것이 좋습니다.
불임
여성
에베롤리무스를 복용한 여성 환자에서 무월경이 발생했습니다. [부작용 (6.2) 참조]. 동물 데이터에 따르면 에베롤리무스는 여성에서 이식 전 손실을 유발할 수 있습니다. [비임상 독성학 (13.1) 참조].
에베롤리무스 치료는 여성의 생식 능력을 저해할 수 있습니다.
남성
에베롤리무스 치료는 인간 [경고 및 주의 사항 (5.18), 부작용 (6.2, 6.3) 참조] 및 동물 연구 결과 [비임상 독성학 (13.1) 참조]에 따라 남성의 생식 능력을 저해할 수 있습니다.
8.5 노인 사용
65세 이상 환자에서 에베롤리무스 사용에 대한 임상 경험은 제한적입니다. 노인 환자는 젊은 성인 환자와 다른 용량 권장 사항을 필요로 한다는 증거는 없습니다. [임상 약리학 (12.5) 참조].
8.6 간 기능 저하
간 기능 저하 환자의 경우 에베롤리무스 전혈 골 농도를 면밀히 모니터링해야 합니다. 경도의 간 기능 저하(Child-Pugh Class A) 환자의 경우 용량을 정상 권장 일일 용량의 약 1/3으로 줄여야 합니다. 중등도 또는 중증의 간 기능 저하(Child-Pugh Class B 또는 C) 환자의 경우 초기 일일 용량을 정상 권장 일일 용량의 약 절반으로 줄여야 합니다. LC/MS/MS 분석으로 측정한 에베롤리무스의 전혈 골 농도가 3~8 ng/mL의 목표 골 농도 범위 내에 있지 않으면 추가 용량 조정 및/또는 용량 적정을 수행해야 합니다. [임상 약리학 (12.6) 참조].
10 과다 복용
사람에서 과량 복용에 대한 보고 경험은 매우 제한적입니다. 2세 어린이에서 에베롤리무스 1.5mg을 우연히 섭취한 경우가 한 건 있는데, 부작용은 관찰되지 않았습니다. 이식 환자에게 최대 25mg의 단일 용량을 투여한 결과 급성 내약성이 허용되었습니다. 최대 70mg의 단일 용량(사이클로스포린 없이)을 투여한 결과 급성 내약성이 허용되었습니다. 과량 복용의 경우 모든 경우에 일반적인 지지 요법을 따라야 합니다. 에베롤리무스는 어느 정도까지도 투석 가능하다고 여겨지지 않습니다(혈액 투석 6시간 이내에 에베롤리무스의 10% 미만 제거). 동물 연구에서 에베롤리무스는 급성 독성 가능성이 낮은 것으로 나타났습니다. 마우스 또는 랫트에서 경구 단일 용량 2,000mg/kg(한계 시험)을 투여한 후 사망 또는 심각한 독성은 관찰되지 않았습니다.
11 설명
에베롤리무스는 매크로라이드 면역억제제입니다. 에베롤리무스의 화학명은 (1R, 9S, 12S, 15R, 16E, 18R, 19R, 21R, 23S, 24E, 26E, 28E, 30S, 32S, 35R)-1, 18-dihydroxy-12 -{(1R)-2-[(1S,3R,4R) 4-(2-hydroxyethoxy)-3-methoxycyclohexyl]-1-methylethyl}-19,30-dimethoxy-15, 17, 21, 23, 29, 35-hexamethyl-11, 36 dioxa-4-aza-tricyclo[30.3.1.04,9] hexatriaconta-16,24,26,28-tetraene-2, 3,10,14,20-pentaone입니다.
분자식은 C53H83NO14이며 분자량은 958.25입니다. 구조식은 다음과 같습니다.

에베롤리무스는 경구 투여용 정제로 제공되며, 에베롤리무스 0.25mg, 0.5mg, 0.75mg 및 1mg과 함께 부틸화 히드록시톨루엔, 크로스포비돈 A형, 히프로멜로스, 무수 락토스, 락토스 일수화물 및 마그네슘 스테아레이트를 비활성 성분으로 함유하고 있습니다.
12 임상약리학
12.1 작용 기전
에베롤리무스는 항원 및 인터루킨(IL-2 및 IL-15) 자극에 의한 T 및 B 림프구의 활성화 및 증식을 억제합니다.
세포 내에서 에베롤리무스는 세포질 단백질인 FK506 결합 단백질-12(FKBP-12)에 결합하여 면역 억제 복합체(에베롤리무스:FKBP-12)를 형성하고, 이는 핵심 조절 키나제인 래파마이신의 포유류 표적(mTOR)에 결합하여 억제합니다. 에베롤리무스가 존재하면 mTOR의 기질인 p70 S6 리보솜 단백질 키나제(p70S6K)의 인산화가 억제됩니다. 결과적으로 리보솜 S6 단백질의 인산화 및 그에 따른 단백질 합성 및 세포 증식이 억제됩니다. 에베롤리무스:FKBP-12 복합체는 칼시뉴린 활성에 영향을 미치지 않습니다.
랫트 및 비인간 영장류 모델에서 에베롤리무스는 신장 이식 거부 반응을 효과적으로 감소시켜 이식편 생존 기간을 연장합니다.
12.3 약동학
에베롤리무스의 약동학은 성인 신장 이식 환자, 간 기능 저하 환자 및 건강한 피험자에게 단회 및 반복 투여 후 경구 투여 후 특성이 규명되었습니다.
흡수
경구 투여 후 에베롤리무스의 최고 혈중 농도는 투여 후 1~2시간에 나타납니다. 1일 2회 0.5mg~2mg의 투여 범위에서 에베롤리무스 Cmax 및 AUC는 안정 상태에서 이식 환자에서 투여량에 비례합니다.
음식 효과
건강한 피험자 24명에서 고지방 아침 식사(지방 44.5g)는 에베롤리무스 Cmax를 60% 감소시키고, Tmax 를 중앙값 1.3시간 지연시키고, 공복 투여와 비교하여 AUC를 16% 감소시켰습니다. 변동성을 최소화하기 위해 에베롤리무스는 음식과 함께 또는 음식 없이 일관되게 복용해야 합니다 [투여 및 투약 방법(2.6) 참조].
분포
에베롤리무스의 혈액-혈장 비율은 농도 의존적이며 5ng/mL~5,000ng/mL 범위에서 17%~73%입니다. 혈장 단백질 결합은 건강한 피험자와 중등도 간 기능 저하 환자에서 약 74%입니다. 유지 요법 신장 이식 환자에서 단회 투여 약동학 연구에서 종말 단계와 관련된 명백한 분포 용적(Vz/F)은 342~107L(범위: 128~589L)입니다.
배설
대사
에베롤리무스는 CYP3A4 및 P-gp의 기질입니다. 경구 투여 후 에베롤리무스는 인체 혈액에서 주요 순환 성분입니다. 에베롤리무스의 6가지 주요 대사 산물이 인체 혈액에서 검출되었으며, 여기에는 3가지 모노 하이드록시화 대사 산물, 2가지 가수 분해적 고리 열린 생성물 및 에베롤리무스의 포스파티딜콜린 접합체가 포함됩니다. 이러한 대사 산물은 독성 연구에 사용된 동물 종에서도 확인되었으며, 에베롤리무스 자체보다 약 100배 낮은 활성을 보였습니다.
배설
방사성 표지된 에베롤리무스를 시클로스포린을 투여받는 이식 환자에게 단회 투여한 후 방사성 동위원소의 대부분(80%)은 대변에서 회수되었고, 소량(5%)만이 소변으로 배설되었습니다. 모 약물은 소변과 대변에서 검출되지 않았습니다.
신장 이식 환자에서의 약동학
안정 상태는 4일째에 도달하며, 첫 번째 투여 후 노출과 비교하여 혈중 농도가 2~3배 축적됩니다. 아래 표 4는 안정 상태 약동학적 매개변수를 요약한 것입니다.
표 4. 1일 2회 0.75mg 투여 후 안정 상태 약동학적 매개변수(평균 +/- SD)
| Cmax |
Tmax |
AUC |
CL/F1 |
Vc/F1 |
반감기(T1/2) |
| 11.1 + 4.6 ng/mL | 1-2 h | 75 + 31 ng•h/mL | 8.8 L/h | 110 L | 30 ± 11h |
12.5 약물 상호 작용
에베롤리무스는 시토크롬 CYP3A4 및 P-gp의 기질로 알려져 있습니다. 에베롤리무스와 동시에 투여되는 약물 간의 약동학적 상호 작용은 아래에 설명되어 있습니다. 아래에 설명된 약물을 제외한 다른 약물과의 약물 상호 작용 연구는 수행되지 않았습니다 [경고 및 주의 사항 (5.14), 약물 상호 작용 (7) 참조].
시클로스포린 (CYP3A4/P-gp 억제제 및 CYP3A4 기질): 신장 이식 환자의 경우 에베롤리무스를 시클로스포린과 동시에 투여해야 합니다. 에베롤리무스 용량을 증가시키지 않는 한 시클로스포린 용량을 감소시키면 에베롤리무스 농도가 감소할 수 있습니다 [용법 및 용량 (2.1), 약물 상호 작용 (7.2) 참조].
건강한 피험자를 대상으로 한 단일 용량 연구에서 시클로스포린 (네오랄)을 175mg 용량으로 투여한 경우 에베롤리무스 2mg과 함께 투여했을 때 에베롤리무스 AUC가 168% (범위: 46%~365%) 증가하고 Cmax가 82% (범위: 25%~158%) 증가했습니다. 에베롤리무스 단독 투여와 비교했습니다 [약물 상호 작용 (7.2) 참조].
케토코나졸 및 기타 강력한 CYP3A4 억제제: 건강한 자원자 12명에게 케토코나졸 200mg을 1일 2회 5일 동안 다중 용량으로 투여한 결과 에베롤리무스 2mg과 함께 투여했을 때 에베롤리무스 Cmax, AUC 및 반감기가 각각 3.9배, 15배 및 89% 증가했습니다. 강력한 CYP3A4 억제제 (예: 케토코나졸, 이트라코나졸, 보리코나졸, 클라리스로마이신, 텔리쓰로마이신, 리토나비어, 보세프레비어, 텔라프레비어)는 에베롤리무스와 함께 투여해서는 안 됩니다 [경고 및 주의 사항 (5.14), 약물 상호 작용 (7.3) 참조].
에리스로마이신 (중간 CYP3A4 억제제): 건강한 자원자 16명에게 에리스로마이신 500mg을 1일 3회 5일 동안 다중 용량으로 투여한 결과 에베롤리무스 2mg과 함께 투여했을 때 에베롤리무스 Cmax, AUC 및 반감기가 각각 2배, 4.4배 및 39% 증가했습니다. 에리스로마이신을 함께 투여하는 경우 에베롤리무스 혈중 농도를 모니터링하고 필요에 따라 용량을 조절해야 합니다 [약물 상호 작용 (7.4) 참조].
베라파밀 (CYP3A4 억제제 및 P-gp 기질): 건강한 자원자 16명에게 베라파밀 80mg을 1일 3회 5일 동안 다중 용량으로 투여한 결과 에베롤리무스 2mg과 함께 투여했을 때 에베롤리무스 Cmax 및 AUC가 각각 2.3배 및 3.5배 증가했습니다. 에베롤리무스 반감기는 변하지 않았습니다. 베라파밀을 함께 투여하는 경우 에베롤리무스 혈중 농도를 모니터링하고 필요에 따라 용량을 조절해야 합니다 [약물 상호 작용 (7.5) 참조].
아토르바스타틴 (CYP3A4 기질) 및 프라바스타틴 (P-gp 기질): 건강한 피험자 12명에게 에베롤리무스 2mg을 단일 용량으로 투여한 후 아토르바스타틴 20mg 또는 프라바스타틴 20mg을 단일 경구 용량으로 동시에 투여한 결과 에베롤리무스 Cmax 및 AUC가 각각 9% 및 10%만 감소했습니다. 평균 T1/2 또는 중앙값 Tmax에는 명백한 변화가 없었습니다. 동일한 연구에서 에베롤리무스 동시 투여 용량은 아토르바스타틴의 평균 Cmax를 11% 약간 증가시키고 AUC를 7% 약간 감소시켰습니다. 에베롤리무스 동시 투여 용량은 프라바스타틴의 평균 Cmax 및 AUC를 각각 10% 및 5% 감소시켰습니다. 에베롤리무스와 아토르바스타틴 및 프라바스타틴을 동시에 투여하는 경우 용량 조절이 필요하지 않습니다 [약물 상호 작용 (7.6) 참조].
미다졸람 (CYP3A4/5 기질): 건강한 남성 피험자 25명에서 미다졸람 4mg 경구 용액을 안정 상태 에베롤리무스 (1일 10mg 용량으로 5일 동안 투여)와 함께 투여한 결과 미다졸람 Cmax 가 25% 증가하고 미다졸람 AUC가 30% 증가했습니다. 미다졸람의 말단 반감기와 대사 AUC 비율 (1 하이드록시미다졸람/미다졸람)은 영향을 받지 않았습니다 [약물 상호 작용 (7.9) 참조].
리팜핀 (강력한 CYP3A4 및 P-gp 유도제): 건강한 피험자 12명에게 리팜핀 (1일 1회 600mg으로 8일 동안 투여)을 다중 용량으로 사전 투여한 후 에베롤리무스 4mg을 단일 용량으로 투여한 결과 에베롤리무스 청소율이 거의 3배 증가하고 Cmax가 58% 감소하고 AUC가 63% 감소했습니다. 리팜핀과의 병용은 권장되지 않습니다 [약물 상호 작용 (7.8) 참조].
12.6 특정 인구집단
간 기능 저하
정상 간 기능을 가진 피험자의 에베롤리무스 AUC와 비교하여, 경도 간 기능 저하(Child-Pugh Class A) 환자 6명에서 10mg 단일 용량 투여 후 평균 AUC가 1.6배 높았습니다. 중등도 간 기능 저하(Child-Pugh Class B) 환자 8명과 9명으로 구성된 독립적으로 연구된 2개 그룹에서 2mg 또는 10mg 단일 용량 투여 후 평균 AUC가 각각 2.1배 및 3.3배 높았습니다. 중증 간 기능 저하(Child-Pugh Class C) 환자 6명에서 10mg 단일 용량 투여 후 평균 AUC가 3.6배 높았습니다. 경도 간 기능 저하(Child-Pugh Class A) 환자의 경우, 정상적으로 권장되는 일일 용량의 약 1/3을 감량해야 합니다. 중등도 또는 중증 간 기능 저하(Child-Pugh Class B 또는 C) 환자의 경우, 초기 일일 용량을 정상적으로 권장되는 일일 용량의 약 1/2로 감량해야 합니다. LC/MS/MS 분석법으로 측정한 에베롤리무스의 전혈 혈중 농도가 3~8 ng/mL의 목표 혈중 농도 범위 내에 있지 않으면, 추가적인 용량 조절 및/또는 용량 적정을 실시해야 합니다. [용법 및 용량 (2.7) 참조].
신장 기능 저하
신장 기능 저하 환자를 대상으로 한 약동학 연구는 수행되지 않았습니다. 이식 후 신장 기능(크레아티닌 청소율 범위: 11~107 mL/min)은 에베롤리무스의 약동학에 영향을 미치지 않았습니다. 따라서 신장 기능 저하 환자의 경우 용량 조절이 필요하지 않습니다.
노인
성인(연구 대상 연령 범위: 16~70세)에서 에베롤리무스 경구 CL/F의 제한적인 감소가 연간 0.33%로 추정되었습니다. 노인 환자에게는 젊은 성인 환자와 다른 용량 권장 사항이 필요하다는 증거가 없습니다.
인종
인구 약동학 분석 결과, 경구 청소율(CL/F)은 흑인 이식 환자에서 평균 20% 높습니다.
12.7 신장 및 간 이식 환자에서 관찰된 에베롤리무스 전혈 농도
신장 이식에서 에베롤리무스
임상 시험의 노출-효능 및 노출-안전성 분석을 기반으로 하며 LC/MS/MS 분석법을 사용하여, 에베롤리무스 전혈 혈중 농도가 3 ng/mL 이상인 신장 이식 환자는 혈중 농도가 3 ng/mL 미만인 환자에 비해 생검으로 확인된 급성 거부 반응의 발생률이 낮은 것으로 나타났습니다. 에베롤리무스 혈중 농도가 6~12 ng/mL 범위에 있는 환자는 3~8 ng/mL 사이의 낮은 혈중 농도를 달성한 환자와 유사한 효능을 보였지만, 부작용이 더 많았습니다. [용법 및 용량 (2.3) 참조].
신장 임상 시험 [임상 연구 (14.1) 참조]에서, 에베롤리무스 전혈 혈중 농도는 3일, 7일, 14일 및 1개월, 2개월, 3개월, 4개월, 6개월, 7개월, 9개월 및 12개월에 측정되었습니다. 에베롤리무스 전혈 혈중 농도가 3일, 7일 및 14일에 프로토콜에서 지정한 3~8 ng/mL의 목표 범위 내에 있는 에베롤리무스 0.75mg 1일 2회 투여 요법을 받은 환자의 비율은 각각 55%, 71% 및 69%였습니다. 이식 후 1개월까지 약 80%의 환자가 3~8 ng/mL의 목표 범위 내에 에베롤리무스 전혈 혈중 농도를 유지했으며, 이식 후 12개월까지 범위 내에서 안정적으로 유지되었습니다. 0.75mg 1일 2회 투여 그룹의 에베롤리무스 혈중 농도 중앙값은 연구 기간 동안 3~8 ng/mL 사이였습니다.
간 이식에서 에베롤리무스
간 임상 시험 [임상 연구 (14.2) 참조]에서, 에베롤리무스 투여는 이식 후 30일 후에 시작되었습니다. 에베롤리무스 전혈 혈중 농도는 첫 번째 투여 후 5일 이내에 측정한 후, 3~4주 동안 매주 간격으로 측정하고, 그 이후로는 매월 측정했습니다. 에베롤리무스 투여 시작 후 1주, 2주 및 4주에 각각 약 49%, 37% 및 18%의 환자가 3 ng/mL 미만이었습니다. 대부분의 환자(약 70~80%)는 이식 후 2개월부터 24개월까지 3~8 ng/mL의 목표 범위 내에 에베롤리무스 혈중 농도를 유지했습니다.
12.8 신장 이식 환자에서 관찰된 사이클로스포린 농도
신장 이식 임상 시험 [임상 연구 (14.1) 참조]에서, 에베롤리무스 0.75mg 1일 2회 투여군의 사이클로스포린 전혈 혈중 농도 목표는 이식 후 1개월까지 100~200 ng/mL, 이식 후 2개월 및 3개월에 75~150 ng/mL, 이식 후 4개월에 50~100 ng/mL, 이식 후 6개월부터 12개월까지 25~50 ng/mL였습니다. 아래 표 5는 연구 기간 동안 관찰된 사이클로스포린 전혈 혈중 농도를 요약한 것입니다.
표 5. 이식 후 12개월 동안의 사이클로스포린 혈중 농도 – 신장 연구 중앙값(ng/mL) 및 10번째 및 90번째 백분위수
| 치료군 |
방문 |
N |
목표(ng/mL) |
중앙값 |
10th 백분위수 |
90th percentile |
| Everolimus Tablets 0.75 mg twice daily |
Day 3 | 242 | 100-200 | 172 | 46 | 388 |
| Day 7 | 265 | 100-200 | 185 | 75 | 337 | |
| Day 14 | 243 | 100-200 | 182 | 97 | 309 | |
| Month 1 | 245 | 100-200 | 161 | 85 | 274 | |
| Month 2 | 232 | 75-150 | 140 | 84 | 213 | |
| Month 3 | 220 | 75-150 | 111 | 68 | 187 | |
| Month 4 | 208 | 50-100 | 99 | 56 | 156 | |
| Month 6 | 200 | 25-50 | 75 | 43 | 142 | |
| Month 7 | 199 | 25-50 | 59 | 36 | 117 | |
| Month 9 | 194 | 25-50 | 49 | 28 | 91 | |
| Month 12 | 186 | 25-50 | 46 | 25 | 100 |
12.9 간 이식 환자의 타크로리무스 농도
간 이식 임상 시험 [임상 연구 참조 (14.2)]에서 타크로리무스 전혈 골 농도는 이식 후 첫 30일 동안 8 ng/mL 이상이었습니다. 프로토콜에 따라 환자는 에베롤리무스 투여 시작 1주일 전에 타크로리무스 골 농도가 8 ng/mL 이상이어야 했습니다. 에베롤리무스는 이식 후 30일 후에 시작되었습니다. 그 시점에서 타크로리무스 골 농도 목표는 3~5 ng/mL로 감소되었습니다. 아래 표 6은 이식 후 24개월까지 연구 기간 동안 관찰된 타크로리무스 전혈 골 농도 요약입니다.
표 6. 이식 후 24개월 동안 타크로리무스 골 농도 – 간 연구 중앙값 (ng/mL) 및 10번째 및 90번째 백분위수
|
치료군 |
방문 |
N |
목표 (ng/mL) |
중앙값 |
10th 백분위수 |
90th 백분위수 |
|
사전 투여군 에베롤리무스 정 1mg 1일 2회 (1개월에 시작) |
4주차 |
234 |
3~5 |
9.5 |
5.8 |
14.6 |
|
5주차 |
219 |
3~5 |
8.1 |
4.5 |
13.8 |
|
|
6주차 |
233 |
3~ 5 |
7.0 |
4.1 |
12.0 |
|
|
2개월 |
219 |
3~ 5 |
5.6 |
3.4 |
10.3 |
|
|
3개월 |
218 |
3~ 5 |
5.2 |
3.1 |
9.7 |
|
|
4개월 |
196 |
3~ 5 |
4.9 |
2.9 |
7.7 |
|
|
5개월 |
195 |
3~ 5 |
4.8 |
2.7 |
7.3 |
|
|
6개월 |
200 |
3~ 5 |
4.6 |
3.0 |
7.5 |
|
|
9개월 |
186 |
3~ 5 |
4.4 |
2.9 |
8.0 |
|
|
12개월 |
175 |
3~ 5 |
4.3 |
2.6 |
7.3 |
|
|
24개월 |
109 |
3~ 5 |
3.8 |
2.3 |
5.5 |
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
에베롤리무스는 2년 동안 매일 경구 투여 시 최대 0.9 mg/kg의 용량에서 마우스 또는 랫드에서 발암성이 없었습니다. 이러한 연구에서 마우스의 AUC는 하루 2회 0.75 mg을 투여받는 사람의 AUC보다 높았습니다(최소 20배). 랫드의 AUC는 하루 2회 0.75 mg을 투여받는 사람의 AUC와 동일한 범위였습니다.
에베롤리무스는 박테리아 역돌연변이, 마우스 림프종 티미딘 키나아제 분석 또는 V79 중국 햄스터 세포를 사용한 염색체 이상 분석 또는 마우스 소핵 분석에서 500 mg/kg을 하루 2회 투여한 후 in vivo에서 돌연변이 유발성이 없었습니다.
랫드에서 13주 동안 수컷 생식능력 경구 투여 연구에서 0.5 mg/kg 이상에서 고환 형태가 영향을 받았고, 정자 운동성, 정자 수 및 혈장 테스토스테론 농도는 수컷 생식능력 감소를 초래한 5 mg/kg에서 감소했습니다. 투여 후 13주 후에 검사한 동물에서 이러한 발견의 가역성이 나타났습니다. 수컷 랫드에서 0.5 mg/kg 용량은 임상 노출 범위의 AUC를 초래했고, 5 mg/kg 용량은 하루 2회 0.75 mg을 투여받는 사람의 AUC의 약 5배인 AUC를 초래했습니다.
암컷 랫드에서 에베롤리무스의 경구 용량이 0.1 mg/kg 이상(시작 용량 0.75mg을 하루 2회 투여받는 환자의 추정 AUC 0-24h의 약 0.13배)이면 이식 전 손실 발생률이 증가했습니다.
13.2 동물 독성 및/또는 약리학
랫드에서 경구 신생아 및 청소년 발달 연구에서 출생 후 7일부터 70일까지 에베롤리무스를 경구 투여하면 눈 뜨는 시기 지연, 수컷과 암컷의 생식 발달 지연, 학습 및 기억 단계 동안 지연 시간 증가를 포함한 발달 랜드마크 달성 지연이 용량 의존적으로 발생했습니다. 0.15 mg/kg/일만큼 낮은 용량에서 관찰되었습니다. 이러한 용량에서 랫드의 노출은 성인 인간 이식 환자에서 얻은 노출과 같거나 적었습니다.
14 임상 연구
14.1 신장 이식 후 장기 거부 반응 예방
24개월, 다국적, 공개 라벨, 무작위 (1:1:1) 시험은 1.5mg/일 시작 용량 (LC/MS/MS 분석법을 사용하여 3~8ng/mL 목표) 및 3mg/일 시작 용량 (LC/MS/MS 분석법을 사용하여 6~12ng/mL 목표)의 두 가지 농도 제어 에베롤리무스 요법을 감소된 노출 사이클로스포린 및 코르티코스테로이드와 비교하여 표준 노출 사이클로스포린 및 코르티코스테로이드와 함께 1.44g/일 미코페놀산을 비교하여 수행했습니다. 에베롤리무스 1.5mg, 3mg 및 미코페놀산 그룹에서 사이클로스포린 평균 시작 용량은 각각 체중 kg당 5.2, 5 및 5.7mg/일이었습니다. 에베롤리무스 그룹의 사이클로스포린 용량은 그 후 표 5에 표시된 혈액 골 농도 범위로 조정되었지만, 미코페놀산 그룹에서는 5일째부터 200~300ng/mL, 2개월에서 12개월까지 100~250ng/mL의 목표 범위가 사용되었습니다.
모든 환자는 바실릭시맙 유도 요법을 받았습니다. 연구 대상은 첫 번째 이식을 받는 18~70세의 남녀 저위험~중위험 신장 이식 수혜자였습니다. 연구에서 저위험~중위험 면역학적 위험은 보체 의존성 세포독성 기반 분석에 의해 항-인간 백혈구 항원 (HLA) 클래스 I 패널 반응성 항체 (PRA)가 20% 미만이거나, 유세포 분석 또는 ELISA 기반 분석에 의해 50% 미만이고, T 세포 교차 일치가 음성인 ABO 혈액형 호환 첫 번째 장기 또는 조직 이식 수혜자로 정의되었습니다. 이식 후 833명의 환자가 무작위 배정되었습니다. 277명은 에베롤리무스 1.5mg/일 그룹에, 279명은 에베롤리무스 3mg/일 그룹에, 277명은 미코페놀산 1.44g/일 그룹에 무작위 배정되었습니다. 이 연구는 유럽, 남아프리카, 북미 및 남미, 아시아 태평양 지역의 79개 신장 이식 센터에서 수행되었습니다. 수혜자 또는 기증자 질환 특성과 관련하여 치료 그룹 간에 주요 기준선 차이가 없었습니다. 모든 그룹의 이식 수혜자 대부분 (70%~76%)은 3개 이상의 HLA 불일치를 보였습니다. 패널 반응성 항체의 평균 비율은 1%~2%였습니다. 12개월 시점의 조기 치료 중단율은 에베롤리무스 1.5mg 및 대조군에서 각각 30% 및 22%였습니다 (p=0.03, Fisher의 정확한 검정). 여성 환자 그룹 간에 더 두드러졌습니다. 12개월 시점의 결과는 에베롤리무스 1.5mg/일이 생검으로 확인된 급성 거부 반응*, 이식편 손실, 사망 또는 추적 관찰에서 제외된 것으로 정의된 효능 실패 측면에서 대조군과 비교할 만하다는 것을 나타냈습니다. 에베롤리무스 및 대조군에서 이러한 종말점과 각 개별 변수를 경험한 환자의 비율은 표 7에 나와 있습니다.
표 7. 신장 이식 후 12개월 시점의 치료 그룹별 효능 실패 (ITT 모집단)
|
에베롤리무스 1.5mg/일 감소된 노출 CsA N=277 n (%) |
미코페놀산 1.44g/일 표준 노출 CsA N=277 n (%) |
|
|
효능 종말점1 |
||
|
효능 실패 종말점2 |
70 (25.3) |
67 (24.2) |
|
치료된 생검으로 확인된 급성 거부 반응 |
45 (16.2) |
47 (17.0) |
|
사망 |
7 (2.5) |
6 (2.2) |
|
이식편 손실 |
12 (4.3) |
9 (3.2) |
|
추적 관찰에서 제외됨 |
12 (4.3) |
9 (3.2) |
|
이식편 손실 또는 사망 또는 추적 관찰에서 제외됨3 |
32 (11.6) |
26 (9.4) |
|
이식편 손실 또는 사망 |
18 (6.5) |
15 (5.4) |
|
추적 관찰에서 제외됨3 |
14 (5.1) |
11 (4.0) |
약어: CsA, 사이클로스포린.
* 생검으로 확인된 급성 거부반응 치료(tBPAR)는 1997년 Banff 기준에 따라 IA, IB, IIA, IIB 또는 III 등급으로 분류된 생검으로 확인된 급성 거부반응으로, 거부반응 치료제로 치료된 경우를 의미합니다.
1 주요 효능 실패 종점에 대한 비율 차이(에베롤리무스-미코페놀산)는 95% 신뢰 구간(CI)으로 1.1%(-6.1%, 8.3%)이며, 이식편 손실, 사망 또는 추적 관찰 손실 종점에 대한 비율 차이는 2.2%(-2.9%, 7.3%)입니다.
2 12개월까지 치료된 BPAR, 이식편 손실, 사망 또는 추적 관찰 손실을 포함하며, 추적 관찰 손실은 치료된 BPAR, 이식편 손실 또는 사망을 경험하지 않고 마지막 연락 날짜가 12개월 방문 전인 환자를 나타냅니다.
3 추적 관찰 손실(이식편 손실, 사망 또는 추적 관찰 손실의 경우)은 사망 또는 이식편 손실을 경험하지 않고 마지막 연락 날짜가 12개월 방문 전인 환자를 나타냅니다.
에베롤리무스 1.5mg(목표 골 농도 3~8ng/mL) 및 미코페놀산 그룹의 추정 평균 사구체 여과율[신장 질환 식이 수정(MDRD) 방정식 사용]은 의도적 치료(ITT) 집단에서 12개월에 비슷했습니다(표 8).
표 8. 신장 이식 후 12개월에 MDRD에 의한 추정 사구체 여과율(mL/min/1.73m2) *
|
에베롤리무스 1.5mg/일 |
미코페놀산 1.44g/일 |
|
|
12개월 GFR (MDRD) |
감소된 노출 CsA N=276 |
표준 노출 CsA N=277 |
|
평균 (SD) |
54.6 (21.7) |
52.3 (26.5) |
|
중앙값 (범위) |
55.0 (0-140.9) |
50.1 (0.0-366.4) |
약어: CsA, 사이클로스포린; MDRD, 신장 질환 식이 수정; SD, 표준 편차.
* 사망 또는 추적 관찰 데이터 손실로 인해 12개월 시점의 누락 데이터에 대해 대상자의 마지막 관찰 값을 사용하여 분석한 결과, 이식편 손실을 경험한 대상자의 경우 값이 0으로 사용되었습니다.
두 건의 이전 연구에서는 TDM 없이 에베롤리무스 1.5mg/일 및 3mg/일의 고정 용량을 표준 노출 사이클로스포린 및 코르티코스테로이드와 함께 미코페놀레이트 모페틸 2g/일 및 코르티코스테로이드와 비교했습니다.
두 연구 모두에서 항림프구 항체 유도는 금지되었습니다. 두 연구 모두 588명과 583명의 신규 신장 이식 환자를 대상으로 한 다기관, 이중맹검(처음 12개월 동안), 무작위 배정 시험(1:1:1)이었습니다. GFR의 12개월 분석 결과, 두 연구 모두에서 에베롤리무스 그룹의 경우 미코페놀레이트 모페틸 그룹에 비해 신장 기능 저하율이 높은 것으로 나타났습니다. 따라서 신장 기능 장애를 피하기 위해 에베롤리무스와 함께 감소된 노출 사이클로스포린을 사용해야 하며, TDM을 사용하여 에베롤리무스 골 농도를 조정하여 골 농도를 3~8ng/mL로 유지해야 합니다. [경고, 용법 및 용량(2.4), 경고 및 주의 사항(5.6) 참조].
14.2 간 이식 후 장기 거부 반응 예방
이식 후 30일부터 시작하여 24개월 동안 다국적, 공개, 무작위 배정(1:1:1) 시험이 간 이식 환자를 대상으로 실시되었습니다. 이식 후 처음 30일 동안, 무작위 배정 전에 환자는 미코페놀레이트 모페틸 유무와 관계없이 타크로리무스와 코르티코스테로이드를 투여받았습니다. 유도 항체는 투여되지 않았습니다. 환자의 약 70~80%가 처음 30일 동안 미코페놀레이트 모페틸을 최소한 1회 투여받았으며, 중앙값 총 일일 용량은 1.5g이었습니다. 자격 요건으로 환자는 무작위 배정 전 1주일 동안 타크로리무스 골 농도가 8ng/mL 이상이어야 했습니다.
무작위 배정 시 미코페놀레이트 모페틸은 중단되었으며, 환자는 두 가지 에베롤리무스 치료 그룹 중 하나에 무작위 배정되었습니다. [1일 2회 1mg(1일 2mg)의 초기 용량으로 시작하여 LC/MS/MS 분석을 사용하여 골 농도를 3~8ng/mL로 목표로 조정] 타크로리무스 노출 감소(전혈 골 농도 목표 3~5ng/mL) 또는 타크로리무스 제거. 타크로리무스 제거 그룹의 경우 이식 후 4개월에 에베롤리무스 골 농도가 6~10ng/mL 목표 범위 내에 있으면 감소된 노출 타크로리무스를 제거했습니다. 에베롤리무스와 타크로리무스 제거 그룹은 급성 거부 반응 발생률이 높아 조기에 중단되었습니다. 대조군의 경우 환자는 표준 노출 타크로리무스(전혈 골 농도 목표 8~12ng/mL, 이식 후 4개월까지 6~10ng/mL로 감소)를 투여받았습니다. 모든 환자는 시험 기간 동안 코르티코스테로이드를 투여받았습니다.
연구 대상자는 첫 이식을 받은 18~70세 남녀 간 이식 수혜자였으며, 평균 연령은 약 54세였고, 환자의 70% 이상이 남성이었으며, 대부분의 환자가 백인이었으며, 각 치료 그룹의 약 89%의 환자가 연구를 완료했습니다. HCV 상태(그룹 간 HCV 양성 31~32%) 및 신장 기능(기준선 eGFR 범위 79~83mL/분/1.73m2)과 같은 주요 계층화 매개변수도 그룹 간에 균형을 이루었습니다.
총 1,147명의 환자가 이 시험의 실행 기간에 등록되었습니다. 이식 후 30일에 연구 포함/제외 기준에 따라 자격을 갖춘 총 719명의 환자가 3가지 치료 그룹 중 하나에 무작위 배정되었습니다. 에베롤리무스와 감소된 노출 타크로리무스; N=245, 에베롤리무스와 타크로리무스 제거(타크로리무스 제거 그룹); N=231, 또는 표준 용량/노출 타크로리무스(타크로리무스 대조군); N=243. 이 연구는 영국과 아일랜드를 포함한 유럽, 북미와 남미, 호주에 있는 89개 간 이식 센터에서 실시되었습니다.
주요 포함 기준은 18~70세 수혜자, eGFR 30mL/분/1.73m2 이상, 무작위 배정 전 1주일 동안 타크로리무스 골 농도 8ng/mL 이상, 경구 약물 복용 가능 여부였습니다.
주요 제외 기준은 다중 고형 장기 이식 수혜자, 악성 종양 병력(밀란 기준 내 간세포암 제외), 인간 면역 결핍 바이러스, 연구 약물의 흡수, 분포, 대사 및 배설에 상당한 영향을 미치는 외과적 또는 의학적 상태였습니다.
수혜자 또는 기증자 질환 특징과 관련하여 치료 그룹 간에 주요 기준선 차이가 없었습니다. 이식 시 평균 MELD 점수, 냉각 허혈 시간(CIT) 및 ABO 일치는 그룹 간에 유사했습니다. 전반적으로 치료 그룹은 간 이식의 주요 결정 요인과 관련하여 비교 가능했습니다.
타크로리무스 제거 그룹은 타크로리무스 제거 단계 동안 보고된 급성 거부 반응 발생률과 치료 중단으로 이어지는 부작용이 높아 조기에 중단되었습니다. 따라서 에베롤리무스와 타크로리무스 제거 치료 요법은 권장되지 않습니다.
24개월까지의 결과는 에베롤리무스와 감소된 노출 타크로리무스가 표준 노출 타크로리무스와 유사하게 효능 실패를 보여주는 것으로 나타났습니다. 효능 실패는 치료된 생검으로 확인된 급성 거부 반응, 이식편 손실, 사망 또는 치료 기간 동안 12~24개월 동안 추적 관찰 데이터 손실로 정의됩니다. 각 시간 간격에 대한 에베롤리무스 그룹과 대조군의 이러한 종점과 각 개별 변수를 경험한 환자의 비율은 표 9에 나와 있습니다.
표 9. 간 이식 후 12개월 및 24개월 시점의 치료 그룹별 효능 실패(ITT 모집단)
|
에베롤리무스(에베롤리무스) 감소된 노출 타크로리무스와 함께 N=245 n (%) |
타크로리무스 표준 노출 N=243 n (%) |
|
|
12개월 시점의 유효성 평가 지표1 |
||
| 복합 유효성 실패 지표1,2 |
22 (9.0) |
33 (13.6) |
| 치료된 생검으로 확인된 급성 거부 반응* | 7 (2.9) | 17 (7.0) |
| 사망 | 13 (5.3) | 7 (2.9) |
| 이식편 손실 | 6 (2.4) | 3 (1.2) |
| 추적 관찰에서 제외2 |
4 (1.6) | 9 (3.7) |
| 이식편 손실 또는 사망 또는 추적 관찰에서 제외 | 18 (7.3) | 18 (7.4) |
| 이식편 손실 또는 사망 | 14 (5.7) | 8 (3.3) |
| 추적 관찰에서 제외 | 4 (1.6) | 10 (4.1) |
|
24개월 시점의 유효성 평가 지표 |
||
| 복합 유효성 실패 지표2 |
45(18.4) |
53(21.8) |
| 치료된 생검으로 확인된 급성 거부 반응 | 11 (4.5) | 18 (7.4) |
| 사망 | 17 (6.9) | 11 (4.5) |
| 이식편 손실 | 9 (3.7) | 7 (2.9) |
| 추적 관찰에서 제외2 |
18 (7.3) | 23(9.5) |
| 이식편 손실 또는 사망 또는 추적 관찰에서 제외3 |
38 (15.5) |
39 (16.0) |
| 이식편 손실 또는 사망 | 20 (8.2) | 15 (6.2) |
| 추적 관찰에서 제외3 |
18 (7.3) | 24(9.9) |
* 생검으로 확인된 급성 거부반응(tBPAR)은 거부반응 활동 지수(RAI)가 3 이상인 조직학적으로 확인된 급성 거부반응으로 거부반응 치료를 받은 경우로 정의되었습니다.
1 효능 실패 종점을 기준으로 12개월 시점의 비율 차이(에베롤리무스 – 대조군)는 Yates 연속성 수정을 적용한 정규 근사를 기반으로 97.5% CI에서 -4.6%(-11.4%, 2.2%)이고, 이식편 손실, 사망 또는 추적 관찰 손실 종점의 경우 -0.1%(-5.4%, 5.3%)입니다.
2 추적 관찰 손실(tBPAR, 이식편 손실, 사망 또는 추적 관찰 손실 치료)은 tBPAR, 이식편 손실 또는 사망을 경험하지 않고 마지막 연락 날짜가 12개월 또는 24개월 방문 전인 환자를 나타냅니다.
3 추적 관찰 손실(이식편 손실, 사망 또는 추적 관찰 손실)은 사망 또는 이식편 손실을 경험하지 않고 마지막 연락 날짜가 12개월 또는 24개월 방문 전인 환자를 나타냅니다.
12개월 시점에 ITT 모집단에서 에베롤리무스 군의 MDRD 방정식을 사용한 추정 사구체 여과율(eGFR)은
80.9 mL/min/1.73m2이고 타크로리무스 대조군은 70.3 mL/min/1.73 m2였습니다. 24개월 시점에 에베롤리무스 군의 MDRD 방정식을 사용한 eGFR은 74.7 mL/min/1.73m2이고 타크로리무스 대조군의 eGFR은
67.8 mL/min/1.73m2였습니다(표 10).
표 10. 간 이식 후 12개월 및 24개월 시점의 MDRD에 따른 추정 사구체 여과율(mL/min/1.73m2)
| eGFR (MDRD) |
감소된 노출 타크로리무스와 함께 에베롤리무스 |
표준 노출 타크로리무스 |
|
12개월 |
N=215 | N=209 |
|
평균(SD) |
80.9 (27.3) |
70.3 (23.1) |
|
중앙값(범위) |
78.3 (28.4-153.1) |
66.4 (27.9-155.8) |
|
24개월 |
N=184 |
N=186 |
|
평균(SD) |
74.7 (26.1) |
67.8 (21.0) |
|
중앙값(범위) |
72.9 (20.3-151.6) |
65.2 (27.0-148.9) |
약어: eGFR, 추정 사구체 여과율; MDRD, 신장 질환의 식이 수정; SD, 표준 편차.
그림 1. 간 이식 후 방문 기간 및 치료에 따른 eGFR(MDRD 4) [mL/min/1.73m2]의 평균 및 95% CI(ITT 모집단 – 24개월 분석)*
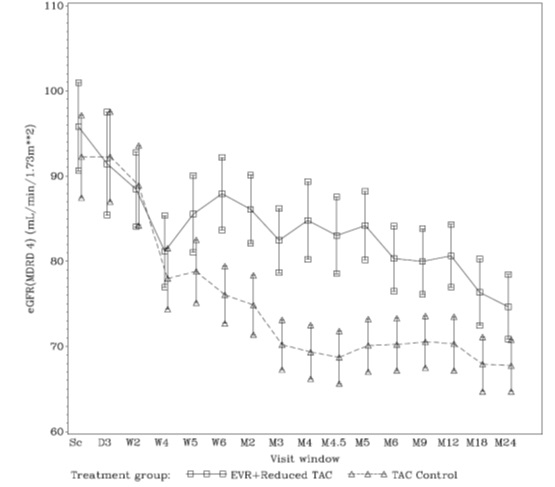
* 에베롤리무스 투약은 이식 후 30일에 시작되었습니다.
초기 프로토콜은 24개월 동안 설계되었지만, 이후 연구 기간이 이식 후 36개월로 연장되었습니다. 에베롤리무스 군의 106명(43%) 환자와 대조군의 125명(51%) 환자가 이식 후 24개월에서 36개월까지 연장 연구에 참여했습니다. 36개월 시점의 에베롤리무스 군 결과는 tBPAR, 이식편 손실, 사망 및 eGFR 측면에서 24개월 시점의 결과와 일치했습니다.
16 제공/보관 및 취급 방법
에베롤리무스 정제는 어린이 보호 포장재로 된 블리스터 포장과 병에 포장되어 있습니다.
표 11. 에베롤리무스 정제의 설명
| 투여 용량 |
0.25 mg |
0.5 mg |
0.75 mg |
1 mg |
| 외관 |
한쪽 면에는 “EVR”, 다른 쪽 면에는 “25”가 각인된 흰색에서 약간 희끄무레한 둥근 정제. | 한쪽 면에는 “EVR”, 다른 쪽 면에는 “50”가 각인된 흰색에서 약간 희끄무레한 둥근 정제. | 한쪽 면에는 “EVR”, 다른 쪽 면에는 “75”가 각인된 흰색에서 약간 희끄무레한 둥근 정제. | 한쪽 면에는 “EVR”, 다른 쪽 면에는 “100”가 각인된 흰색에서 약간 희끄무레한 둥근 정제. |
| NDC 번호 병 60개 |
67877-718-60 |
67877-719-60 | 67877-720-60 | 67877-721-60 |
| NDC 번호 블리스터 |
67877-718-33 | 67877-719-33 | 67877-720-33 | 67877-721-33 |
| NDC 번호 카톤 |
67877-718-31 | 67877-719-31 | 67877-720-31 | 67877-721-31 |
각 용량은 60정(10정씩 6개의 블리스터 스트립) 상자로 제공됩니다.
보관
25°C(77°F)에 보관하십시오. 15°C~30°C(59°F~86°F)까지의 온도 변화는 허용됩니다. [USP 제어 실온 참조] 빛과 습기로부터 보호하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨링(복용 안내서)을 읽도록 권고하십시오.
투여
에베롤리무스는 음식물 섭취 여부와 관계없이 약 12시간 간격으로 하루에 두 번 경구 복용해야 한다는 것을 환자에게 알리십시오.
에베롤리무스의 혈중 약물 농도를 증가시키는 자몽과 자몽 주스를 피하도록 환자에게 알리십시오. [경고 및 주의사항 (5.20) 참조].
에베롤리무스는 감량된 용량의 사이클로스포린과 함께 사용해야 하며, 이러한 약물의 용량 변경은 의사의 감독 하에 이루어져야 한다는 것을 환자에게 알리십시오. 사이클로스포린 용량을 변경하면 에베롤리무스 정제의 용량도 변경해야 할 수 있습니다.
에베롤리무스 정제를 복용하는 동안 의사의 권고에 따라 반복적인 실험실 검사가 필요하다는 것을 환자에게 알리십시오.
림프종 및 기타 악성 종양 발생
면역 억제로 인해 특히 피부에 림프종 및 기타 악성 종양이 발생할 위험이 있음을 환자에게 알리십시오. 보호복을 착용하고 자외선 차단 지수가 높은 자외선 차단제를 사용하여 햇빛과 자외선(UV)에 대한 노출을 제한하도록 환자에게 조언하십시오. [경고 및 주의사항 (5.2) 참조].
감염 위험 증가
면역 억제로 인해 기회 감염을 포함한 다양한 감염이 발생할 위험이 증가한다는 것을 환자에게 알리십시오. 감염 증상이 나타나면 의사에게 연락하도록 환자에게 조언하십시오. [경고 및 주의사항 (5.3, 5.13) 참조].
신장 이식편 혈전증
에베롤리무스는 신장 동맥 및 정맥 혈전증의 위험 증가와 관련이 있으며, 일반적으로 이식 후 처음 30일 이내에 이식편 손실을 초래합니다. [경고 및 주의사항 (5.4) 참조].
에베롤리무스 및 칼시뉴린 억제제 유도 신독성
에베롤리무스와 사이클로스포린을 병용할 경우 신장 기능 손상 위험과 두 약물 모두에 대한 일상적인 혈중 농도 모니터링의 필요성에 대해 환자에게 조언하십시오. 혈청 크레아티닌 모니터링의 중요성에 대해 환자에게 조언하십시오. [경고 및 주의사항 (5.6) 참조].
혈관 부종
혈관 부종의 위험과 ACE 억제제의 병용 사용이 이러한 위험을 증가시킬 수 있음을 환자에게 알리십시오. 증상이 나타나면 즉시 치료를 받도록 환자에게 조언하십시오. [경고 및 주의사항 (5.8) 참조].
상처 치유 합병증 및 체액 축적
에베롤리무스 사용은 상처 치유 손상 또는 지연, 체액 축적, 절개 부위의 주의 깊은 관찰 필요성과 관련이 있다는 것을 환자에게 알리십시오. [경고 및 주의사항 (5.9) 참조].
간질성 폐 질환(ILD)/비감염성 폐렴
에베롤리무스 사용은 비감염성 폐렴의 위험을 증가시킬 수 있음을 환자에게 알리십시오. 폐렴과 일치하는 임상 증상이 나타나면 치료를 받도록 환자에게 조언하십시오. [경고 및 주의사항 (5.10) 참조].
고지혈증
에베롤리무스 사용은 치료가 필요할 수 있는 혈청 콜레스테롤 및 트리글리세리드 증가와 혈중 지질 농도 모니터링의 필요성과 관련이 있다는 것을 환자에게 알리십시오. [경고 및 주의사항 (5.11) 참조].
단백뇨
에베롤리무스 사용은 단백뇨 위험 증가와 관련이 있다는 것을 환자에게 알리십시오. [경고 및 주의사항 (5.12) 참조].
임신 및 수유
가임 여성에게 치료 기간 및 에베롤리무스 치료 중단 후 8주 동안 임신을 피하도록 조언하십시오. 에베롤리무스는 임신 중에 복용하면 태아에게 해를 끼칠 수 있습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 또한 에베롤리무스를 복용하는 동안 모유 수유를 하지 않도록 조언하십시오. [특정 집단에서의 사용 (8.1, 8.2) 참조].
남성 및 여성의 생식력
에베롤리무스가 생식력을 손상시킬 수 있음을 남녀 환자에게 알리십시오. [경고 및 주의사항 (5.18), 특정 집단에서의 사용 (8.1, 8.3), 비임상 독성학 (13.1) 참조].
에베롤리무스 정제와 상호 작용하는 약물
일부 약물은 에베롤리무스의 혈중 농도를 높이거나 낮출 수 있습니다. 항진균제, 항생제, 항바이러스제, 카르바마제핀, 페니토인, 바르비투르산염을 포함한 항간질제, 허브/식이 보충제(세인트존스워트), 칸나비디올 및/또는 리팜피신을 복용하는 경우 의사에게 알리도록 환자에게 조언하십시오. [경고 및 주의사항 (5.14, 5.22) 참조].
새로운 당뇨병 발병
에베롤리무스 사용은 당뇨병의 위험을 증가시킬 수 있으며 증상이 나타나면 의사에게 연락하도록 환자에게 알리십시오. [경고 및 주의사항 (5.16) 참조].
예방 접종
에베롤리무스로 치료받는 동안 예방 접종의 효과가 떨어질 수 있음을 환자에게 알리십시오. 생백신은 피해야 한다고 환자에게 조언하십시오. [경고 및 주의사항 (5.19) 참조].
유전 질환이 있는 환자
갈락토스 불내성(라프-락타아제 결핍증 또는 글루코스-갈락토스 흡수 장애)의 유전 질환이 있는 경우 에베롤리무스를 복용하지 않도록 의사에게 알리라고 환자에게 조언하십시오. [경고 및 주의사항 (5.21) 참조].
제조:
Alkem Laboratories Ltd.,
인도.
유통:
Ascend Laboratories, LLC
Parsippany, NJ 07054
개정일: 2024년 3월
약물 안내문
에베롤리무스 정제 (E-ver-OH-li-mus)
에베롤리무스 정제에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
에베롤리무스 정제는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
• 특정 암에 걸릴 위험 증가. 에베롤리무스 정제를 복용하는 사람들은 림프종 및 기타 암, 특히 피부암에 걸릴 가능성이 더 높습니다. 암 위험에 대해 의사와 상담하십시오.
• 심각한 감염 위험 증가. 에베롤리무스 정제는 신체의 면역 체계를 약화시키고 감염과 싸우는 능력에 영향을 미칩니다. 에베롤리무스 정제로 인해 사망에 이를 수 있는 심각한 감염이 발생할 수 있습니다. 에베롤리무스 정제를 복용하는 사람들은 바이러스, 박테리아 및 곰팡이(효모)로 인한 감염에 걸릴 가능성이 더 높습니다.
o 발열이나 오한을 포함한 감염 증상이 나타나면 의사에게 연락하십시오.
• 이식된 신장의 혈관에 혈전. 이 경우 일반적으로 신장 이식 후 처음 30일 이내에 발생합니다. 다음과 같은 경우 즉시 의사에게 알리십시오.
o 사타구니, 허리 아래, 옆구리 또는 복부(배)에 통증이 있는 경우
o 소변량이 줄거나 소변을 보지 못하는 경우
o 소변에 피가 섞여 나오거나 소변 색깔이 진한 경우(차 색깔)
o 발열, 메스꺼움 또는 구토가 있는 경우
• 이식된 신장에 심각한 문제(신독성). 에베롤리무스 정제와 함께 복용할 때 사이클로스포린의 복용량을 낮게 시작해야 합니다. 의사는 에베롤리무스 정제와 사이클로스포린의 수치를 정기적으로 검사해야 합니다.
• 심장 이식을 받은 사람의 경우 감염과 관련된 사망 위험 증가. 의사와 상담하지 않고 심장 이식을 받은 경우 에베롤리무스 정제를 복용해서는 안 됩니다.
“에베롤리무스 정제의 가능한 부작용은 무엇입니까?” 섹션을 참조하여 다른 심각한 부작용에 대한 정보를 확인하십시오.
에베롤리무스 정제는 무엇입니까?
에베롤리무스는 신장 이식 또는 간 이식을 받은 사람의 이식 거부 반응을 예방하는 데 사용되는 처방약(거부 반응 방지 약물)입니다. 이식 거부 반응은 신체의 면역 체계가 새로 이식된 신장이나 간을 “이물질”로 인식하고 공격할 때 발생합니다.
에베롤리무스 정제는 이식된 신장의 거부 반응을 예방하기 위해 사이클로스포린, 코르티코스테로이드 및 기타 이식 약물과 함께 사용됩니다. 에베롤리무스 정제는 이식된 간의 거부 반응을 예방하기 위해 타크로리무스 및 코르티코스테로이드와 함께 사용됩니다.
에베롤리무스 정제가 신장과 간 이외의 다른 이식된 장기에 안전하고 효과적인지 여부는 알려져 있지 않습니다. 에베롤리무스 정제가 18세 미만의 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
다음과 같은 경우 에베롤리무스 정제를 복용하지 마십시오.
• 에베롤리무스(에베롤리무스 정제/AFINITOR®) 또는 에베롤리무스 정제의 성분에 알레르기가 있는 경우. 에베롤리무스 정제의 성분 목록은 이 약물 안내서의 끝부분을 참조하십시오.
• 시롤리무스(Rapamune®)
에베롤리무스 정제를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의사에게 알리십시오.
• 간 문제가 있는 경우
• 피부암이 있거나 가족력이 있는 경우
• 콜레스테롤이나 트리글리세리드(혈액 내 지방) 수치가 높은 경우
• 라프 락타아제 결핍증 또는 포도당-갈락토오스 흡수 장애가 있는 경우. 이러한 장애가 있는 경우 에베롤리무스 정제를 복용해서는 안 됩니다.
• 임신 중이거나 임신할 수 있는 경우. 에베롤리무스 정제는 태아에게 해를 끼칠 수 있습니다. 임신 가능성이 있는 경우 에베롤리무스 정제 치료 중 및 마지막 복용 후 8주 동안 효과적인 피임 방법을 사용해야 합니다. 이 기간 동안 적합한 피임 방법에 대해 의사와 상담하십시오. 임신 중이거나 임신했을 수 있다고 생각되면 즉시 의료 서비스 제공자에게 알리십시오. 에베롤리무스 정제 치료 중에는 임신해서는 안 됩니다.
• 모유 수유 중이거나 모유 수유를 계획 중인 경우. 에베롤리무스가 모유로 이행되는지 여부는 알려져 있지 않습니다.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의사에게 알리십시오.
특히 다음과 같은 약물을 복용하는 경우 의사에게 알리십시오.
• 항진균제
• 항생제
• 심장 약물
• 고혈압 약물
• 콜레스테롤이나 트리글리세리드를 낮추는 약물
• 사이클로스포린 (Sandimmune®, Gengraf®, Neoral®)
• 결핵(TB) 약물
• HIV 약물
• 세인트 존스 워트
• 발작(항경련제) 약물
• 칸나비디올 (Epidiolex®)
에베롤리무스 정제는 어떻게 복용해야 합니까?
• 에베롤리무스 정제는 의사의 지시대로 정확히 복용하십시오.
• 절대로 의사의 지시 없이 에베롤리무스 정제 복용을 중단하거나 복용량을 변경하지 마십시오.
• 에베롤리무스 정제는 사이클로스포린 또는 타크로리무스 약물 복용과 동시에 복용하십시오.
• 절대로 의사의 지시 없이 사이클로스포린 또는 타크로리무스 약물 복용을 중단하거나 복용량을 변경하지 마십시오.
• 의사가 사이클로스포린 또는 타크로리무스 복용량을 변경하면 에베롤리무스 정제 복용량도 변경될 수 있습니다.
• 에베롤리무스 정제는 하루에 2번 약 12시간 간격으로 복용하십시오.
• 에베롤리무스 정제는 물 한 잔과 함께 통째로 삼키십시오. 에베롤리무스 정제를 부수거나 씹지 마십시오.
• 에베롤리무스 정제는 음식과 함께 또는 음식 없이 복용할 수 있습니다. 에베롤리무스 정제를 음식과 함께 복용하는 경우 항상 음식과 함께 복용하십시오. 에베롤리무스 정제를 음식 없이 복용하는 경우 항상 음식 없이 복용하십시오.
• 에베롤리무스 정제를 복용하는 동안 의사는 신장 또는 간 기능을 정기적으로 검사하기 위해 혈액 검사를 실시할 것입니다. 의사가 지시하는 대로 검사를 받는 것이 중요합니다. 혈액 검사는 신장 또는 간 기능을 모니터링하고 에베롤리무스 정제와 다른 이식 약물(사이클로스포린 또는 타크로리무스)의 적절한 복용량을 확인하는 데 도움이 됩니다.
• 에베롤리무스 정제를 과량 복용한 경우 즉시 의사에게 연락하거나 가장 가까운 병원 응급실로 가십시오.
에베롤리무스 정제 복용 중에 무엇을 피해야 합니까?
• 에베롤리무스 정제를 복용하는 동안 어떤 생백신도 접종하지 마십시오. 에베롤리무스 정제를 복용하는 동안 일부 백신은 효과가 없을 수 있습니다.
• 에베롤리무스 정제를 복용하는 동안 자몽이나 자몽 주스를 먹지 마십시오. 자몽은 혈중 에베롤리무스 정제 수치를 높일 수 있습니다.
• 햇볕에 노출되는 시간을 제한하십시오. 태닝 베드나 선탠 램프 사용을 피하십시오. 에베롤리무스 정제를 복용하는 사람들은 피부암에 걸릴 위험이 더 높습니다. “에베롤리무스 정제에 대해 가장 중요한 정보는 무엇입니까?” 섹션을 참조하십시오. 햇볕에 나갈 때는 보호 의복을 착용하고 높은 자외선 차단 지수(SPF 30 이상)가 있는 자외선 차단제를 사용하십시오. 이는 특히 피부가 밝거나 가족력에 피부암이 있는 경우 더욱 중요합니다.
• 임신을 피하십시오. “에베롤리무스 정제를 복용하기 전에 의사에게 무엇을 알려야 합니까?” 섹션을 참조하십시오.
에베롤리무스 정제의 가능한 부작용은 무엇입니까?
에베롤리무스 정제는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
• “에베롤리무스 정제에 대해 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
• 피부 아래, 특히 입, 눈 주변과 목구멍에 부종(안지오에데마)이 나타날 수 있습니다. 특정 다른 약물과 함께 에베롤리무스 정제를 복용하는 경우 피부 아래 부종이 발생할 위험이 더 높습니다. 다음과 같은 안지오에데마 증상이 나타나면 즉시 의사에게 알리거나 가장 가까운 응급실로 가십시오.
o 얼굴, 입, 목, 혀 또는 손의 갑작스러운 부종
o 두드러기 또는 팽진
o 가렵거나 통증이 있는 부은 피부
o 호흡 곤란
• 상처 치유 지연. 에베롤리무스 정제는 절개 부위가 천천히 치유되거나 잘 치유되지 않도록 할 수 있습니다. 다음과 같은 증상이 나타나면 즉시 의사에게 연락하십시오.
o 절개 부위가 붉고 따뜻하거나 통증이 있는 경우
o 절개 부위에서 피, 체액 또는 고름이 나오는 경우
o 절개 부위가 벌어지는 경우
o 절개 부위가 부어오르는 경우
• 폐 또는 호흡 문제. 새로운 기침, 호흡 곤란, 호흡 곤란 또는 천명이 발생하거나 악화되면 즉시 의사에게 알리십시오. 일부 환자의 경우 폐 또는 호흡 문제가 심각하여 사망에 이를 수도 있습니다. 의사는 에베롤리무스 정제 복용을 중단하거나 복용량을 줄여야 할 수도 있습니다.
• 콜레스테롤 및 트리글리세리드(혈액 내 지방) 증가. 콜레스테롤 및 트리글리세리드 수치가 높으면 의사는 식단, 운동 및 특정 약물을 사용하여 수치를 낮추려고 할 수 있습니다.
• 소변 내 단백질(단백뇨).
• 신장 기능 변화. 에베롤리무스 정제는 표준 용량의 사이클로스포린 약물 대신 낮은 용량을 사용하는 경우 신장 문제를 일으킬 수 있습니다.
의사는 콜레스테롤, 트리글리세리드 및 신장 기능을 모니터링하기 위해 혈액 및 소변 검사를 실시해야 합니다.
• 바이러스 감염. 면역 체계가 약화되면 신체에 존재하는 특정 바이러스가 활성 감염을 일으킬 수 있습니다. 에베롤리무스 정제로 인해 발생할 수 있는 바이러스 감염에는 BK 바이러스 관련 신병증이 있습니다. BK 바이러스는 신장 기능에 영향을 미쳐 이식된 신장이 기능을 상실할 수 있습니다.
• 혈액 응고 문제. 이것이 우려되는 사항이면 의사와 상담하십시오.
• 당뇨병. 잦은 배뇨, 갈증 증가 또는 식욕 증가가 있는 경우 의사에게 알리십시오.
• 남성 불임. 에베롤리무스 정제는 남성의 생식 능력에 영향을 미칠 수 있으며 자녀를 낳는 능력에 영향을 미칠 수 있습니다. 이것이 우려되는 경우 의사와 상담하십시오.
• 여성 불임. 에베롤리무스 정제는 여성의 생식 능력에 영향을 미칠 수 있으며 임신 능력에 영향을 미칠 수 있습니다. 이것이 우려되는 경우 의사와 상담하십시오.
신장 또는 간 이식을 받은 사람들에게서 에베롤리무스 정제의 가장 흔한 부작용은 다음과 같습니다.
이러한 흔한 부작용은 신장 및 간 이식 환자 모두에게 보고되었습니다.
• 메스꺼움
• 다리, 발목 및 발의 부종
• 고혈압
신장 이식을 받은 사람들에게서 에베롤리무스 정제의 가장 흔한 부작용은 다음과 같습니다.
• 변비
• 적혈구 수 감소(빈혈)
• 요로 감염
• 혈중 지방 증가(콜레스테롤 및 트리글리세리드)
간 이식을 받은 사람들에게서 에베롤리무스 정제의 가장 흔한 부작용은 다음과 같습니다.
• 설사
• 두통
• 발열
• 복통
• 백혈구 감소
이것들은 에베롤리무스 정제의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. 부작용을 FDA에 보고할 수 있습니다. 1-800-FDA-1088.
에베롤리무스 정제는 어떻게 보관해야 합니까?
• 에베롤리무스 정제는 59°F에서 86°F(15°C에서 30°C) 사이에 보관하십시오.
• 에베롤리무스 정제를 빛으로부터 보호하십시오.
• 에베롤리무스 정제를 건조하게 보관하십시오.
에베롤리무스 정제와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
에베롤리무스 정제의 안전하고 효과적인 사용에 대한 일반 정보.
의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 에베롤리무스 정제를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 에베롤리무스 정제를 주지 마십시오. 해를 입힐 수 있습니다.
의료 전문가를 위해 작성된 에베롤리무스 정제에 대한 정보는 의사 또는 약사에게 문의할 수 있습니다.
에베롤리무스 정제의 성분은 무엇입니까? 활성 성분: 에베롤리무스
비활성 성분: 부틸화 히드록시톨루엔, 크로스포비돈 A형, 히프로멜로스, 무수 락토스, 락토스 일수화물 및 마그네슘 스테아레이트.
제조사:
Alkem Laboratories Ltd.,
INDIA.
판매원:
Ascend Laboratories, LLC
Parsippany, NJ 07054
이 의약품 안내서는 미국 식품의약국에서 승인했습니다.
개정: 2024년 3월
PT9077-02
패키지 라벨.주요 표시 패널
NDC 67877-721-60
Everolimus Tablets 1 mg
Rx only
60 Tablets

NDC 67877-718-31
Everolimus Tablets 0.25 mg
Rx only
6 blister cards of 10 tablets each
NDC 67877-719-31
Everolimus Tablets 0.5 mg
Rx only
6 blister cards of 10 tablets each
NDC 67877-720-31
Everolimus Tablets 0.75 mg
Rx only
6 blister cards of 10 tablets each
NDC 67877-721-31
Everolimus Tablets 1 mg
Rx only
6 blister cards of 10 tablets each


